Natriumchlorit (NACLO2) -Struktur, Eigenschaften, Verwendung, Risiken

- 2634
- 585
- Said Ganzmann
Er Natriumchlorit Es ist ein anorganischer Feststoff, der von einem Ion -Natrium na gebildet wird+ und ein Ion Chlorit Clo2-. Seine chemische Formel ist Naclo2. Es ist ein kristalliner weißer Feststoff, sondern auch ein starkes Oxidationsmittel. Daher muss es sehr vorsichtig sein.
Die Hauptverwendung ist als Desinfektionsmittel für viele Anwendungen. Es ermöglicht die Beseitigung von Mikroben auf Oberflächen wie Böden, Wänden und Laborgeräten in Krankenhäusern und Kliniken und in ihren Wassersystemen.
 Natriumchlorit Naclo2 solide. Autor: Chemikalischinteresse . Quelle: Wikimedia Commons.
Natriumchlorit Naclo2 solide. Autor: Chemikalischinteresse . Quelle: Wikimedia Commons. Ebenfalls in landwirtschaftlichen und tierärztlichen Einrichtungen, um Vogeleikubatoren zu hygienisieren, Infektionen von Milchkühen zu kontrollieren, Wassersysteme für Tiere zu desinfizieren, usw.
In der Lebensmittelindustrie dienen ihre angesäuerten wässrigen Lösungen zum Waschen von Fleisch, Hühnern, Obst, Gemüse sowie der Ausrüstung solcher Einrichtungen.
Mit Natriumchlorit kann Chlordioxid hergestellt werden2 Auf dem Gebrauchsort, sodass Sie Mikroben, schlechte Gerüche und Wasseraromen beseitigen können, damit es angenehm ist und ohne Probleme trinken kann.
Es dient unter anderem auch dazu, Papiermulpe, Gemüse -Textilfasern und Öle zu verblassen.
Der NaClo2 Solid muss mit Vorsicht behandelt werden, da in Kontakt mit bestimmten Materialxplosionen auftreten kann. Ihre Lösungen sind etwas einfacher zu manipulieren, aber sie sind sehr oxidierend und ätzend.
[TOC]
Struktur
Natriumchlorit besteht aus einem Natrium -Na -Kation+ und ein Anionenchlorit -Clo2- Deshalb sind sie durch eine ionische Bindung vereint.
Das Chloritanion hat ein Chloratom in einem Oxidationszustand von +3 und zwei Sauerstoffatome mit jeweils Valencia -2. Aus diesem Grund hat das Chloritanion eine negative Belastung.
Es hat auch eine Winkelstruktur, die in einem Winkel abgehalten wird.
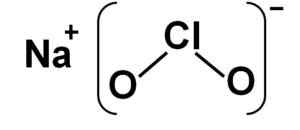 Naclo Natriumchloritstruktur2. Autor: Marilú Stea.
Naclo Natriumchloritstruktur2. Autor: Marilú Stea. Nomenklatur
- Natriumchlorit
- Natriumchlorit
- Natriumsalz aus Chlor
Eigenschaften
Körperlicher Status
Kristalliner weißer Feststoff.
Molekulargewicht
90,44 g/mol.
Schmelzpunkt
Es zersetzt sich, wenn es zwischen 180 und 200 ºC schmilzt.
Dichte
2.468 g/cm3
Löslichkeit
Wasserlöslich: 64 g/100 g Wasser bei 17 ºC. Leicht löslich in Methanol.
Andere Eigenschaften
Es ist leicht hygroskopisch.
Es ist ein starkes Oxidationsmittel. Reagiert heftig mit brennbaren Materialien und Reduzierern. Reagiert heftig mit Säuren und erzeugt Chlordioxid CLO2.
Kann Ihnen dienen: Hume-rothery RegelnSeine alkalischen Lösungen (es bedeutet in Gegenwart von naOH) sind ziemlich stabil, während in saurem Medium die Chlor -Säure -HCLO gebildet wird2, was sich schnell zersetzt:
4 HCLO2 → 2 clo2↑ + clo3- + Cl- + 2 h+ + H2ENTWEDER
Risiken
Sowohl Naclo2 solide als ihre wässrigen Lösungen sind potenziell gefährlich und erfordern viel Vorsicht und Erfahrung während ihrer Manipulation und Lagerung.
Der NaClo2 Solid kann explodieren, wenn sie mit organischen Substanzen wie Handschuhen und Kleidung, Verschüttungsmaterialien wie Sägemehl und Verschwendung von Baumwolle sowie Ölen und Fetten in Kontakt kommen, in Kontakt kommen.
Die feste Form ist daher sehr schwer zu transportieren und es wird bevorzugt, sie in Form von wässrigen Lösungen zu verwenden.
Diese Lösungen sind äußerst ätzend. Sie sollten vorzugsweise einen pH -Wert über 8 behalten, dh einen alkalischen pH -Wert.
Der NaClo2 beschleunigt die Verbrennung von Verbindungen oder brennbaren Materialien bis zu dem Punkt, dass es mit diesen explosiven Gemischen bilden kann.
Wenn Sie erhitzt werden, emittieren Sie giftige Raucher von HCl -Salzsäure und Natriumoxid Na2ENTWEDER. Wenn es verlängert wird, um zu heizen oder zu feuern, kann es ausnutzen.
Erhalten
Es wird beginnend mit der chemischen oder elektrochemischen Reduktion von Sodio Naclo hergestellt3, In Gegenwart von HCl -Salzsäure zur Herstellung von Chlordioxid -Clo -Clo2.
Letzteres reagiert mit Wasserstoffperoxid H2ENTWEDER2 In NaOH -Natriumhydroxid wässrige Lösung und eine Natrium -Natriumchlorit -Lösung wird erhalten2, was den Feststoff verdunstet und kristallisiert.
Es kann auch erhalten werden, indem Chlordioxidgas vorbeigekommen ist2 Für eine NaOH -Lösung.
2 Clo2 + 2 NaOH → Naclo2 + Naclo3 + H2ENTWEDER
Anwendungen
Als Mikrobizid und Desinfektionsmittel in mehreren Anwendungen
Es ist ein Bestandteil zahlreicher Produkte, die dazu dienen, Bakterien, Pilze und Schlamm- oder Algen -Schlamm zu kontrollieren. Produkte, die es zu diesem Zweck enthalten.
Es dient als Desinfektionsmittel vieler Arten von Materialien und Oberflächen.
In der Landwirtschaft sind Geflügel und ähnliche Industrien desinfizierte harte Oberflächen, Ausrüstung, Einrichtungen zur Inkubation von Vogeleier, Gewächshäuser für Pilze wie Pilze und Kühlwasser- und Wasserwassersysteme für Vögelstifte.
Es hat tierärztliche Verwendung als topisches Desinfektionsmittel bei der Kontrolle der Mastitis von Milchvieh, um die Brustwarzen des Tieres zu vertiefen. Mastitis ist eine Infektion von Kühen Euter.
Kann Ihnen dienen: Adiabatischer Prozess: Typen, Beispiele, gelöste Übungen Manchmal muss man Kühe in Natriumchloritlösungen eintauchen, um Infektionen darin zu vermeiden. Autor: Hans Braxmeier. Quelle: Pixabay.
Manchmal muss man Kühe in Natriumchloritlösungen eintauchen, um Infektionen darin zu vermeiden. Autor: Hans Braxmeier. Quelle: Pixabay. Es wird auch in natürlichen Forschungseinrichtungen verwendet, um Laboratorien zu dekontaminieren.
Zu den gewerblichen, industriellen und medizinischen Verwendungen gehören Desinfektionslüftungssysteme, harte Oberflächen (wie Böden, Wände, Laborgeräte) und Wassersysteme.
In Gesundheitseinrichtungen wie Kliniken und Krankenhäusern wird es zum Dekontaminieren von Räumen, Korridoren, Isolationsbereichen und materiellen Sterilisation verwendet.
Es ist auch nützlich für die Hygienisierung in Einrichtungen, in denen Menschen Wasser- oder Spa -Gesundheitsbehandlungen unterzogen werden.
In der Lebensmittelindustrie wird es als frausend verwendet, um Lebensmittel zu erhalten.
Es wird in Form von angesäuertem Natriumchlorit verwendet. Dies wird durch Zugabe von Säure -Säure (Zitronensäure, Phosphorsäure, Radsäure oder Natriumsäuresulfat) zu einer wässrigen Lösung von Natriumchlorit produziert.
Angesäuerte Natriumchlorit hat antimikrobielle Eigenschaften und wird als Tau- oder Hühnchenwasch- oder Einweichenlösung, Fleisch, Gemüse, Obst und Meersprodukte verwendet. Auch in Wasser, um Hühnchen oder Vögel einzufRENNEN.
In Haushalten ermöglicht es, harte Oberflächen wie Böden und Badezimmer, Heizungs- oder Klimaanlagen sowie Poolwasserzirkulationssysteme zu desinfizieren.
 Um Pools zu desinfizieren, können Sie Natriumchlorit NACLO verwenden2. Autor: Age Global Group. Quelle: Pixabay.
Um Pools zu desinfizieren, können Sie Natriumchlorit NACLO verwenden2. Autor: Age Global Group. Quelle: Pixabay.  Produkte, die Natriumchlorit enthalten. Autor: Michal Jarmoluk. Quelle: Pixabay.
Produkte, die Natriumchlorit enthalten. Autor: Michal Jarmoluk. Quelle: Pixabay. Es wird auch in kleinen Beuteln zusammen mit anderen Verbindungen verkauft, um Gas- und Kontrollgerüche in Häusern freizusetzen.
Trinkwasser desinfizieren
Es wird bei der Reinigung von Wasser zum Trinken verwendet, wirkt als Oxidationsmittel und verbessert den Geschmack und den Geruch von Trinkwasser.
Natriumchlorit wird häufig als Vorläufer für die Erzeugung von Clo Chlordioxid verwendet2 Dies dient dazu, Trinkwasser für den menschlichen Verbrauch zu behandeln, dh Mikroorganismen, Gerüche und unangenehme Aromen und können trinken.
CLO erzeugen2 HCl kann verwendet werden:
5 Naclo2 + 4 HCl → 4 CLO2↑ + 5 NaCl + 2 h2ENTWEDER
Der Clo2 Es ist ein antimikrobielles Mittel mit hohem Oxidationsmittel und breitem Spektrum. Das heißt, wirkt gegen eine große Anzahl von Mikroorganismen.
Es kann Ihnen dienen: Kaliumnitrit (KNO2): Struktur, Eigenschaften und VerwendungMikroorganismen sind deaktiviert, weil der CLO2 stört wichtige Enzyme dieser und Zellmembranen Proteine. Es hat auch den Vorteil, dass es keine Organochlorverbindungen produziert, die giftig sind.
Es gibt Natriumchlorit -Tabletten zum Verkauf mit anderen Verbindungen, die im Wasser gelöst sind und sofort die CLO produzieren2 auf kontrollierte Weise, wodurch das Wasser desinfiziert wird.
 Natriumchlorit wird mit anderen Verbindungen verwendet, um Trinkwasser zum Trinken zu erhalten. Autor: Ulrike Leone. Quelle: Pixabay.
Natriumchlorit wird mit anderen Verbindungen verwendet, um Trinkwasser zum Trinken zu erhalten. Autor: Ulrike Leone. Quelle: Pixabay. Das Hauptproblem bei der Behandlung von Wasser, um Aromen zu entfernen und durch CLO zu riechen2 Es besteht darin, dass während der Behandlung giftige Chlorit- und Chlorsalze gebildet werden können.
Für die Kontaktlinsenpflege
Der NaClo2 Es ist eine Komponente der Lösungen, die zur Desinfektion von Kontaktlinsen verwendet werden.
Eine NaClo -Kombination wird verwendet2 und Spuren (sehr kleine Mengen) von Wasserstoffperoxid H2ENTWEDER2.
Die h2ENTWEDER2 Stabilisieren Sie den Clo2 Das wird gebildet und die Kombination von beiden ist sehr effektiv gegen Bakterien, Pilze und Hefen. Die Produkte, die dann sind, sind Natriumchlorid, Wasser und Sauerstoff, die harmlos sind, was bedeutet, dass sie für das Auge nicht schädlich sind.
Wenn die Objektive aus der Lösung entfernt werden, Naclo2 Residual zersetzt sich schnell in Nall und o2. Restperoxid reizt das Auge nicht. Daher sind diese Lösungen sehr sicher.
 Die Lösungen für desinfizierende Kontaktlinsen haben Natriumchlorit unter ihren Zutaten. Autor: nieuw ~ commonswiki. Quelle: Wikimedia Commons.
Die Lösungen für desinfizierende Kontaktlinsen haben Natriumchlorit unter ihren Zutaten. Autor: nieuw ~ commonswiki. Quelle: Wikimedia Commons. In verschiedenen Anwendungen
Natriumchlorit wird zur Herstellung von Chlordioxid verwendet2 Für sofortige Verwendung in einer Vielzahl von Anwendungen, von denen einige in früheren Absätzen behandelt wurden.
Es dient dazu, Holzzellstoff, Textilien wie Baumwolle, Pflanzenfasern, essbare und nicht generbbare Öle, Fette, Lacken, Lecker und Wachse zu verblassen.
Es ist ein Bestandteil von Augentropfen und einigen Lösungen für das mündliche Waschen.
Es wird in der Lederverarbeitungsindustrie und in Agenten für Metallelektrode (Metallbeschichtung) verwendet.
Verweise
- Williams, l. et al. (2019). Mikrobiologie, Linsenpflege und Wartung. In Kontaktlinsen (Sechste Ausgabe). Von Scientedirect erholt.com.
- ODER.S. Nationalbibliothek für Medizin. (2019). Natriumchlorit. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Grau, n.F. (2014). Chlordioxid. Prozesstechnologie. In der Mikrobiologie von Krankheiten mit Wasserbetrieb (zweite Ausgabe). Von Scientedirect erholt.com.
- McKen, l. (2012). Einführung in die Lebensmittelradition und die medizinische Sterilisation. Chlordioxid. Bei der Sterilisation auf Kunststoff und Elastomere (dritte Ausgabe). Von Scientedirect erholt.com.
- Ortenberg, e. und Telsch, b. (2003). Geschmacks- und Geruchsprobleme in Trinkwasser. Im Handbuch der Wasser- und Abwassermikrobiologie. Von Scientedirect erholt.com.
- Karsa, d.R. (2007). Biozide. Chlordioxid. Im Handbuch zur Reinigung/Dekontamination von Oberflächen. Von Scientedirect erholt.com.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Ullmanns Enzyklopädie der industriellen Chemie. (1990). FÜNFTE AUSGABE. VCH Verlagsgellschaft MBH.

