Chlorgeschichte, Eigenschaften, Struktur, Risiken, verwendet

- 2006
- 349
- René Riediger
Er Chlor Es ist ein chemisches Element, das durch das CL -Symbol dargestellt wird. Es ist das zweite der Halogene unter dem Fluor und ist auch das drittelndste elektronegativste Element von allen. Sein Name stammt aus seiner gelblich grünen Farbe, die intensiver als der von Fluor ist.
Im Volksmund, wenn jemand seinen Namen hört, was zuerst denkt in den Bleichprodukten für die Kleidung und im Wasser der Pools. Obwohl Chlor in solchen Beispielen effektiv wirkt, ist es nicht sein Gas, sondern seine Verbindungen (insbesondere Hypochlorit), die die entfärbende und desinfektionelle Wirkung ausüben.
 Rundkolben mit gasöses Chlor im Inneren. Quelle: Larenmclane [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Rundkolben mit gasöses Chlor im Inneren. Quelle: Larenmclane [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Im oberen Bild wird ein runder Kolben mit gasöses Chlor gezeigt. Seine Dichte ist größer als die der Luft, was erklärt, warum sie in der Flasche bleibt und nicht zur Atmosphäre entkommt; Wie bei anderen helleren Gasen, um Helium oder Stickstoff zu sagen. In diesem Zustand ist es eine äußerst giftige Substanz, da sie Salzsäure in der Lunge produziert.
Deshalb hat elementares oder gasöses Chlor nicht zu viele Verwendungen, mehr als in einer Synthese. Seine Verbindungen, ob Salze oder chlorierte organische Moleküle, decken jedoch ein gutes Repertoire an Verwendungszwecken ab, platzieren sich jenseits der Pools und Kleidung extremer Weißer.
Auch seine Atome in Form von Chloridanionen befinden sich in unserem Körper und regulieren Natrium-, Kalzium- und Kaliumspiegel sowie im Magensaft. Wenn nicht, wäre die Natriumchloridaufnahme noch tödlicher.
Chlor tritt durch Soleelektrolyse auf, die reich an Natriumchlorid ist, Industrieverfahren, bei dem ebenfalls Natrium- und Wasserstoffhydroxid erhalten werden. Und weil die Meere eine fast unerschöpfliche Quelle dieses Salzes sind, sind die potenziellen Reserven dieses Elements in der Hydrosphäre sehr groß.
[TOC]
Geschichte
Erste Ansätze
Aufgrund der hohen Reaktivität des gasförmigen Chlors haben alte Zivilisationen ihre Existenz nie vermutet. Ihre Verbindungen waren jedoch Teil der Kultur der Menschheit aus gestern; Seine Geschichte begann mit gemeinsamem Salz verbunden.
Andererseits entstand Chlor aus vulkanischen Ausbrüchen und als jemand Gold in königlicher Wasser löste; Aber keiner dieser ersten Ansätze reichte aus, um die Idee zu formulieren, dass dieses gelbliche grüne Gas ein zusammengesetztes Element war.
Entdeckung
Die Entdeckung von Chlor wird dem schwedischen Chemiker Carl Wilhelm Scheele zugeschrieben, der 1774 die Reaktion zwischen dem Pyrolusit -Mineral und der Salzsäure (bis dann Muriatsäure genannt) machte (bis Muriatsäure).
Scheele bleibt bei dem Kredit, da er der erste Wissenschaftler war, der die Eigenschaften von Chlor untersuchte. Obwohl er zuvor von Jan Baptist Van Helmont (1630) anerkannt wurde.
Die Experimente, mit denen Scheele seine Beobachtungen erhalten hat.
Er benachrichtigte auch seinen hohen Reaktiv gegenüber Metallen, seinen erstickenden Geruch und seinen unerwünschten Effekt auf die Lunge und dass seine Säure, als er sich in Wasser auflöste, zunahm.
Oimuriatinsäure
Bis dahin betrachteten Chemikalien eine Säure zu all jener Verbindung, die Sauerstoff besaß; Also haben sie das Chlor übersehen, sollte ein gasförmiges Oxid sein. Es war so, dass sie es "Oxyuriatsäure" (Muriatsäuroxid) nannten, der vom berühmten französischen Chemiker Antoine Lavoissier geprägt wurde.
1809 versuchten Joseph Louis Gay-Lussac und Louis Jacques Thénard, diese Kohlenstoffsäure zu reduzieren; Reaktion durch Metalle aus ihren Oxiden. Auf diese Weise wollten sie das chemische Element aus der mutmaßlichen Oximuriatsäure (die sie als "Deflistic Act of Muriatsäure" bezeichneten, extrahieren.
Gay-Lussac und Thénard scheiterten jedoch in ihren Experimenten; Aber sie waren erfolgreich, als sie in Betracht gezogen haben, dass das gelbliche grüne Gas ein chemisches Element und keine Verbindung sein sollte.
Erkennung als Element
Die Erkennung von Chlor als chemisches Element war Sir Humphry Davy zu verdanken, der 1810 seine eigenen Experimente mit Kohleelektroden durchführte und zu dem Schluss kam, dass es tatsächlich ein solches Oxid von Muriatsäure gab.
Und außerdem war es Davy, der den Namen "Chlor" für dieses Element aus dem griechischen Wort "Chloros" geprägt hat, was gelblich ist.
Als sie die chemischen Eigenschaften von Chlor untersuchten, wurde festgestellt, dass viele ihrer Verbindungen die Naturkalzität hatten; Daher benannten sie ihn als "Halogen", was Verkaufsformator bedeutet. Dann wurde der Begriff Halogen mit den anderen Elementen derselben Gruppe verwendet (F, Br und I).
Michael Faraday hat es sogar geschafft zu verflüssigen2· H2ENTWEDER.
Kann Ihnen dienen: Effektive nukleare BelastungDer Rest der Chlorgeschichte ist mit seinen Desinfektions- und Bleicheigenschaften verbunden, mit der Entwicklung des industriellen Prozesses der Salzelektrolyse, um massive Mengen an Chlor zu erzeugen.
Physikalische und chemische Eigenschaften
Aussehen
Es handelt sich.
Atomnummer (z)
17
Atomares Gewicht
35,45 u.
Sofern nicht anders angegeben, entsprechen der Rest der Eigenschaften den Größen, die für molekulares Chlor, CL, gemessen wurden2.
Siedepunkt
-34,04 ºC
Schmelzpunkt
-101,5 ºC
Dichte
-Unter normalen Bedingungen 3,2 g/l
-Nur am Siedepunkt, 1.5624 g/ml
Beachten Sie, dass flüssiges Chlor ungefähr fünfmal mehr ist als sein Gas. Auch die Dichte seines Dampfes ist 2,49 -mal höher als die Luft. Deshalb neigt das Chlor im ersten Bild nicht dazu, aus dem runden Kolben zu entkommen, da sich im Hintergrund dichter als die Luft befindet. Diese Funktion macht immer noch ein gefährlicheres Gas.
Fusionshitze
6,406 kJ/mol
Verdampfungswärme
20.41 kJ/mol
Molarenwärmekapazität
33,95 J/(mol · k)
Wasserlöslichkeit
1,46 g/100 ml bei 0 ºC
Dampfdruck
7,67 atm bei 25 ºC. Dieser Druck ist im Vergleich zu anderen Gasen relativ niedrig.
Elektronegativität
3.16 auf der Paulingskala.
Ionisationsenergien
-Erstens: 1251.2 kJ/mol
-Zweitens: 2298 kJ/mol
-Dritte: 3822 kJ/mol
Wärmeleitfähigkeit
8,9 · 10-3 W/(m · k)
Isotope
Chlor tritt hauptsächlich als zwei Isotope in der Natur auf: 35Cl, mit einer Fülle von 76%und 37Cl, mit einer Fülle von 24%. Somit ist das Atomgewicht (35,45 U) ein Durchschnitt der Atommassen dieser beiden Isotope, wobei ihre jeweiligen Prozentsätze der Häufigkeit.
Alle Chlor -Radioisotope sind künstlich, darunter die 36CL als stabilste mit einem halben Leben von 300.000 Jahren.
Oxidationszahlen
Chlor kann mehrere Zahlen oder Oxidationszustände haben, wenn es Teil einer Verbindung ist. Als einer der elektronegativsten Atome in der Periodenzüchttabelle weist es normalerweise negative Oxidationszahlen auf. Außer wenn es mit Sauerstoff oder Fluor läuft, in dessen Oxiden bzw. Fluoriden Elektronen "verlieren" müssen.
In seinen Oxidationszahlen wird die Existenz oder das Vorhandensein von Ionen mit der gleichen Lastgröße angenommen. So haben wir: -1 (cl-, Das berühmte Chloridanion), +1 (Cl+), +2 (Cl2+), +3 (cl3+), +4 (Cl4+), +5 (Cl5+), +6 (cl6+) und +7 (cl7+). Von allen sind die -1, +1, +3, +5 und +7 die häufigsten in chlorierten Verbindungen vorhanden.
Beispiele im CLF und CLF3 Die Oxidationszahlen für Chlor sind +1 (CL)+F-) und +3 (cl3+F3-). Im Cl2Oder das ist +1 (cl2+ENTWEDER2-); während im Clo2, Cl2ENTWEDER3 und Cl2ENTWEDER7, Sohn +4 (Cl4+ENTWEDER22-), +3 (cl23+ENTWEDER32-) und +7 (cl27+ENTWEDER72-).
In allen Chloriden hingegen hat Chlor eine Oxidationszahl von -1; wie im Fall von NaCl (NA+Cl-), Wo es gültig ist zu sagen, dass das CL existiert- Angesichts der ionischen Natur dieses Salzes.
Elektronische Struktur und Konfiguration
Chlormolekül
 Diatom -Chlor -Molekül, das mit einem Raumfüllungsmodell dargestellt wird. Quelle: Benjah-BMM27 über Wikipedia.
Diatom -Chlor -Molekül, das mit einem Raumfüllungsmodell dargestellt wird. Quelle: Benjah-BMM27 über Wikipedia. Chloratome in ihrem Grundzustand haben die folgende elektronische Konfiguration:
[Ne] 3s2 3p5
Daher hat jeder von ihnen sieben Elektronen Valencia. Wenn sie nicht mit Energie überladen sind, gibt es im Raum einzelne Atome, als wären sie grüne Murmeln. Seine natürliche Tendenz ist es jedoch, kovalente Bindungen zwischen ihnen zu formen, um ihre Oktetten von Valencia zu vervollständigen.
Beachten Sie, dass sie kaum ein Elektron benötigen, um acht Valenzelektronen zu haben, sodass sie ein einzelnes einfaches Glied bilden. Dies ist derjenige, der zwei CL -Atome verbindet, um das CL -Molekül zu erzeugen2 (oberes Bild), CL-Cl-Cl. Deshalb ist Chlor unter normalen und/oder terrestrischen Bedingungen ein molekulares Gas; Nicht -monoatomisch, wie es bei edlen Gasen der Fall ist.
Intermolekulare Wechselwirkungen
Die Molekula Cl2 Es ist homonukleär und apolar. In einer Soda -Phase der Abstand CL2-Cl2 Es ist im Vergleich zu anderen Gasen relativ kurz.
Licht kann elektronische Übergänge innerhalb der molekularen Orbitale des CL anregen und fördern2; Folglich erscheint seine charakteristische gelblich grüne Farbe. Diese Farbe verschärft sich im flüssigen Zustand und verschwindet dann teilweise, wenn sie sich verfestigt.
Kann Ihnen dienen: Schwache BasenWenn die Temperatur abfällt (-34 ºC), die CL-Moleküle2 Sie verlieren kinetische Energie und die Distanz CL2-Cl2 nimmt ab; Daher kohärten sie und definieren am Ende flüssiges Chlor. Das Gleiche gilt, wenn das System (-101 ºC) weiter abgekühlt ist, jetzt mit den CL-Molekülen2 So definieren Sie einen ortorrombischen Kristall.
Die Tatsache, dass es Chlorkristalle gibt, ist darauf hin, dass ihre dispersiven Kräfte ausreichend richtend sind, um ein strukturelles Muster zu erzeugen. Dies ist molekulare Schichten von CL2. Die Trennung dieser Schichten ist so, dass seine Struktur selbst unter einem Druck von 64 GPa modifiziert ist, und sie zeigen auch nicht elektrische leitende.
Wo ist es und erhalten
Chloridsalze
 Die robusten Kristalle von St. Quelle: Eltern Géry [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Die robusten Kristalle von St. Quelle: Eltern Géry [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Chlor in seinem gasförmigen Zustand kann nirgendwo auf der Erdoberfläche gefunden werden, da es sehr reaktiv ist und Chloride bildet. Diese Chloride sind in der Kruste der Erde gut ausgebreitet und nach Millionen von Jahren, die durch die Regenfälle gezogen wurden, sind die Meere und die Ozeane bereichert.
Unter allen Chloriden ist die NaCl del Mineral -Halita (überlegenes Bild) das häufigste und reichlichste; gefolgt von den Mineralien in Silvina, KCL und Carnalita, MGCL2· Kcl · 6h2ENTWEDER. Wenn die Wassermassen durch die Wirkung der Sonne verdunsten.
Soleelektrolyse
NaCl löst sich in Wasser auf, um eine Sole (26%) zu produzieren, zu der die Elektrolyse in eine Chloralkalzelle unterzogen wird. Dort finden zwei Semi -Reaktionen in den Anoden- und Kathodenabteilungen statt:
2cl-(Ac) => cl2(g) + 2e- (Anode)
2H2Oder (l) + 2e- => 2OH-(Ac) + h2(g) (Kathode)
Und die globale Gleichung für beide Reaktionen lautet:
2nacl (ac) + 2h2Oder (l) => 2naoh (ac) + h2(g) + cl2(G)
Während die Reaktion stattfindet, na Ionen+ Auf der Anode gebildet sie migrieren in den Kathodenkompartiment, der eine durchlässige Asbestmembran überquert. Aus diesem Grund befindet sich der NaOH auf der rechten Seite der globalen Gleichung. Beide Gase, CL2 und h2, Sie werden von Anode und Kathode gesammelt.
Das untere Bild zeigt das neue geschriebene:
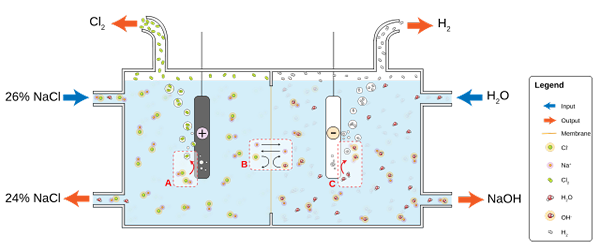 Diagramm für die Chlorproduktion durch Salzelektrolyse. Quelle: jkwchui [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Diagramm für die Chlorproduktion durch Salzelektrolyse. Quelle: jkwchui [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Beachten Sie, dass die Konzentration der Salzlösung am Ende um 2% abnimmt (sie steigt von 24 auf 26%), was den Teil seines CL bedeutet- Originale, die in CL -Moleküle verwandelt wurden2. Am Ende hat die Industrialisierung dieses Prozesses eine Methode zur Herstellung von Chlor-, Wasserstoff- und Natriumhydroxid gewährt.
Saure Auflösung von Pyrolusit
Wie im Abschnitt Geschichte erwähnt, kann das gasförmige Chlor durch Lösen von Proben von Pyrolusit -Erz mit Salzsäure erzeugt werden. Die folgende chemische Gleichung zeigt die Produkte, die aus der Reaktion erhalten wurden:
Mne2(s) + 4hcl (ac) => mcl2(Ac) + 2h2Oder (l) + cl2(G)
Legierungen
Aus zwei einfachen Gründen gibt es keine Chlorlegierungen.
Andererseits sind Chloride auch nicht wünschenswert, da sie einmal in Wasser gelöst werden, einen Kochsalzlösungseffekt ausüben, der die Korrosion in Legierungen fördert. Und daher lösen sich Metalle auf, um Metallchloride zu bilden. Der Korrosionsprozess für jede Legierung ist unterschiedlich; Einige sind anfälliger als andere.
Chlor ist folglich kein guter Additiv für Legierungen; Noch als Cl2 noch wie Cl- (Und die Atome wären sehr reaktiv, damit sie überhaupt existieren können).
Risiken
Obwohl die Löslichkeit von Chlor in Wasser niedrig ist, reicht es aus, in der Luftfeuchtigkeit unserer Haut zu produzieren und die Salzsäure zu Augen, die das Gewebe korrodieren und schwerwiegende Reizungen und sogar den Sichtverlust verursachen.
Noch schlimmer ist es, ihre gelblich grünlichen Dämpfe zu atmen, da es einmal in der Lunge Säuren erzeugt und das Lungengewebe schädigt. Damit erfährt die Person Schmerzen, Husten und Atemschwierigkeiten aufgrund der in der Lunge gebildeten Flüssigkeiten.
Wenn es eine Chlor -Flucht gibt, steht es vor einer besonders gefährlichen Situation: Luft kann seine Dämpfe nicht einfach "fegen"; Bleiben Sie dort, bis sie langsam reagieren oder sich zerstreuen.
Kann Ihnen dienen: Präzisionsausgleich: Merkmale, Funktionen, Teile, verwendetDarüber hinaus handelt es sich um eine stark oxidierende Verbindung, sodass mehrere Substanzen auf den geringsten Kontakt explosionsartig reagieren können. Wie bei Stahlwolle und Aluminium. Aus diesem Grund müssen alle notwendigen Überlegungen ein gespeichertes Chlor vorhanden sein, um Brandrisiken zu vermeiden.
Ironischerweise ist Gas Chlor tödlich, sein Chloridanion nicht giftig; Es kann verbraucht werden (in Maßen), brennt oder reagiert nur mit Fluorid und anderen Reagenzien.
Anwendungen
Synthese
Etwa 81 % des jährlichen Gas Chlors sind für die Synthese organischer und anorganischer Chloride bestimmt. Abhängig vom Kovalenzgrad dieser Verbindungen kann Chlor als bloße Cl-Atome in chlorierten organischen Molekülen (mit C-Cl-Bindungen) oder als Cl-Ionen gefunden werden- In ein paar Chloridsalzen (NaCl, Cacl2, Mgcl2, usw.).
Jede dieser Verbindungen hat seine eigenen Anwendungen. Zum Beispiel Chloroform (CHCL3) und Ethylchlorid (CH3CH2CL) sind Lösungsmittel, die als Inhalationsanästhetika verwendet wurden; Der Diclorometano (CH2Cl2) und Kohlenstofftetrachlorid (CCL4), Ihrerseits, werden in den Laboratorien für organische Chemie häufig eingesetzt.
Wenn diese chlorierten Verbindungen flüssig sind, sind sie meistens als Lösungsmittel für organische Reaktionen bestimmt.
In anderen Verbindungen stellt das Vorhandensein von Chloratomen im Dipolmoment einen Anstieg dar, sodass sie in größerem Maße mit einer polaren Matrix interagieren können; Eine durch Proteine, Aminosäuren, Nukleinsäuren usw. geformte usw., Biomoleküle. Daher hat Chlor auch Papier zur Synthese von Arzneimitteln, Pestiziden, Insektiziden, Fungiziden usw.
In Bezug auf anorganisch-.
Biologisch
Gas- oder Elementarchlor spielt keine Rolle innerhalb von Lebewesen, als ihr Gewebe zu zerstören. Dies bedeutet jedoch nicht, dass ihre Atome im Körper nicht gefunden werden können. Zum Beispiel Clionen- Sie sind im zellulären und extrazellulären Medium sehr reichlich vorhanden und tragen dazu bei+ und ca2+, meistens.
Ebenso ist Salzsäure Teil des Magensafts, mit dem die Nahrung im Magen verdaut wird; seine Clionen-, In Begleitung von H3ENTWEDER+, Definieren Sie den pH -Wert in der Nähe von 1 dieser Sekrete.
Chemische Waffen
Die Dichte des gasförmigen Chlors macht es zu einer tödlichen Substanz, wenn es verschüttet oder in geschlossene oder offene Räume gegossen wird. Ein Strom von Dener als Luft zu sein, zeichnet ein Strom nicht leicht Chlor, so.
Zum Beispiel im Ersten Weltkrieg wurde dieses Chlor auf Schlachtfeldern verwendet. Einmal freigelassen, schlich er sich in die Gräben, um die Soldaten zu ersticken und sie zu zwingen, an die Oberfläche zu gehen.
Desinfektionsmittel
 Die Pools sind chloronisiert, um die Reproduktion und Ausbreitung von Mikroorganismen zu vermeiden. Quelle: Pixabay.
Die Pools sind chloronisiert, um die Reproduktion und Ausbreitung von Mikroorganismen zu vermeiden. Quelle: Pixabay. Die chloronisierten Lösungen, die in Wasser gelöst und dann mit einem Puffer alkalisiert wurden, haben hervorragende Desinfektionsmitteleigenschaften und hemmen die Gewebefäule. Sie wurden verwendet, um offene Wunden zu desinfizieren, um pathogene Bakterien zu eliminieren.
Poolwasser ist genau chloronisiert, um Bakterien, Mikroben und Parasiten zu beseitigen, die es beherbergen können. Zu diesem Zweck wurde früher gasöses Chlor verwendet, aber seine Wirkung ist ziemlich aggressiv. Stattdessen werden Natriumhypochloritlösungen (Bleichmittel) oder Trichlorisozialsäure (ATC) verwendet (ATC).
Das Vorstehende zeigt, dass es nicht der CL ist2 Derjenige, der die Desinfektionswirkung ausübt, aber die HCLO, Hypochloritsäure, die Radikale erzeugt oder ·, die Mikroorganismen zerstören.
Bleichen
Chlor ist sehr ähnlich zu seiner Desinfektionswirkung und bleicht auch die Materialien, weil die Farben für den HCLO verantwortlich sind. Somit sind seine chloronisierten Lösungen ideal, um die Flecken aus weißen Kleidungsstücken zu entfernen oder Papierzellstoff zu bleichen.
Polyvinylchlorid
Die wichtigste chlorierte Verbindung von allen, für die etwa 19% der verbleibenden Produktion von gasöses Chlor zugeordnet sind, ist Vinylpolychlorid (PVC). Dieser Kunststoff hat mehrere Anwendungen. Damit werden Wasserrohre hergestellt, die Fensterrahmen, Wände aus Wänden und Böden, elektrische Kabel, intravenöse Beutel, Mäntel usw.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Chlor. Abgerufen von: in.Wikipedia.Org
- Laura h. et al. (2018). Struktur von festem Chlor bei 1.45 gpazeschrift für kristallgraphie. Kristalline Materialien, Band 234, Ausgabe 4, Seiten 277-280, ISSN (Online) 2196-7105, ISSN (Druck) 2194-4946, doi: doi.org/10.1515/ZKRI-2018-2145
- Nationales Zentrum für Biotechnologie Information. (2019). Chlor. Pubchem -Datenbank. CID = 24526. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Marques Miguel. (S.F.). Chlor. Geborgen von: nautilus.Fis.UC.Pt
- American Chemistry Council. (2019). Chlorchemie: Einführung in Chlor. Erholt von: Chlor.Americachemistry.com
- Fong-Yan Ma. (S.F.). Korrosive Wirkungen von Chloriden auf Metalle. Abteilung für Marine Engineering, Republik China Ntou (Taiwan).
- Der Staat New York. (2019). Die Fakten über Chlor. Erholt von: Gesundheit.NY.Regierung
- DR. Doug Stewart. (2019). Chlorelement -Fakten. Chemicool. Erholt von: Chemicoolool.com

