Aluminiumchlorid (Alcl3)
- 2675
- 680
- Ibrahim Steuk
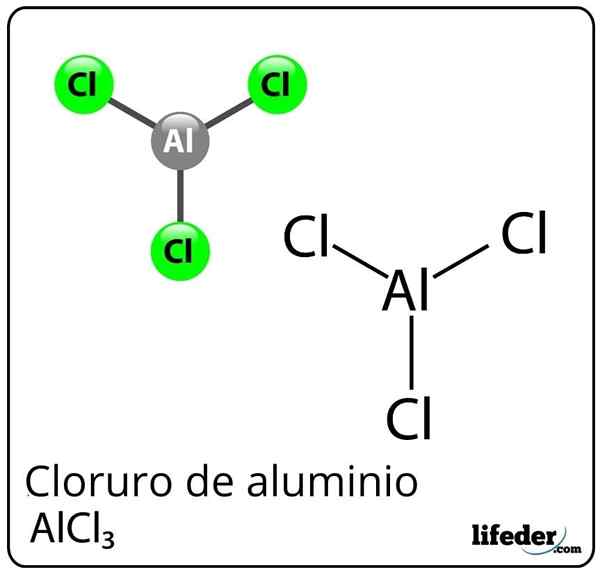
 Formel und Struktur von Aluminiumchlorid
Formel und Struktur von Aluminiumchlorid Was ist Aluminiumchlorid?
Er Aluminiumchlorid Es ist eine anorganische chemische Verbindung, deren Formel Alcl ist3. Es wird als fester oder weißer Staub dargestellt, obwohl es aufgrund einer Kontamination mit Eisen Chlorid und Feuchtigkeit gelb werden kann. Es besteht aus einer Lewis -Säure, aber unter bestimmten Umständen verhält es sich auch als Lewis -Basis.
Trotz Aluminium als Metall im Periodenziegeltisch besteht eine kovalente Bindung zwischen Aluminium und Chlor zur Bildung von Aluminiumchlorid.
Diese kovalente Bindung könnte erklären, warum geschmolzenes Aluminiumchlorid ein schlechter Stromleiter ist; Während die geschmolzenen Salze anderer Verbindungen wie Natriumchlorid gute Stromleiter sind.
Aluminiumchlorid wird durch eine exotherme Reaktion zwischen Aluminium und Chlor oder Wasserstoffchlorid bei einer Temperatur zwischen 650 und 750 ° C erzeugt.
Aluminiumchlorid wird als Antitranspirant verwendet, um übermäßiges Schwitzen zu bekämpfen. Eines seiner Derivate wird als Koagulansmittel bei der Behandlung von industriellem Abwasser verwendet und auch als Hauptkatalysator bei den chemischen Reaktionen der Branche verwendet.
Aluminiumchloridstruktur
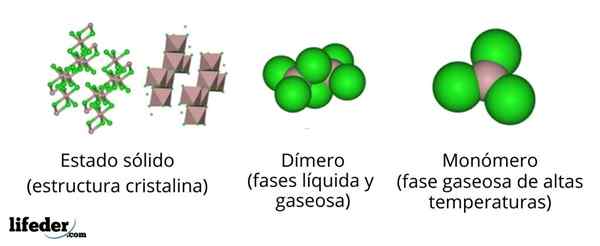
Im oberen Bild haben wir unterschiedliche Darstellungen für jede der kristallinen oder molekularen Strukturen, die das wasserfreie Aluminiumchlorid Alcl aufweisen3, In mehreren seiner physischen Zustände.
Die Alcl3 Feststoff besteht aus einer monoklinen kristallinen Struktur, die durch miteinander koordinierte Schichten von Oktaedros gebildet wird. In diesen Oktaeder (braune Farbe) das Ion zu3+ Es ist mit sechs Cl -Ionen koordiniert-, Schauspielchloride als Brücken zwischen zwei Oktaeder.
Wenn die Temperatur zunimmt und die Alll gegründet wird3, Die Schichten werden in Einheiten an die getrennt2Cl6 (Bildzentrum). Jetzt bildet das Aluminiumatom Links mit drei Chloratomen und einem Zusammenhang mit dem anderen Aluminiumatom: CL3Al-Alcl3. Diese Dimere erklären, warum die ALCL3 geschmolzen ist weniger dicht als seine Kristalle.
Kann Ihnen dienen: Gadolinio: Struktur, Eigenschaften, erhalten, verwendet, verwendetIn der Dampfphase die Dimere an die2Cl6 Sie distanzieren sich gegenseitig. Wenn dieser Dampf jedoch hohen Temperaturen ausgesetzt ist, dissoziiert das Dimer in molekularen Einheiten ALCL3, in dem das Aluminiumatom drei Verbindungen mit Chloratomen bildet. Die Alcl3 präsentiert eine trigonale flache Geometrie.
Aluminiumchlorideigenschaften
 Feste Probe von Aluminiumchlorid mit gelblichen Tönen. Quelle: xlollitox, CC von 3.0, über Wikimedia Commons
Feste Probe von Aluminiumchlorid mit gelblichen Tönen. Quelle: xlollitox, CC von 3.0, über Wikimedia Commons Formeln
Alcl3 (wasserfrei)
Alcl3· 6h2O (Hexahydrat)
Molmasse
133.34 g/mol (Anhydro)
241.43 g/mol (Hexahydrat)
Aussehen
Kristalliner fester oder weißer Staub. Es kann aufgrund der Kontamination mit Eisen Chlorid zu einem gelblichen Farbton werden. Sie können auch eine graue Farbe für die Feuchtigkeit wechseln.
Schmelzpunkt
192.4 ºC
Siedepunkt
Sublima bei 178 ° C, daher ist es nicht einfach, den Siedepunkt von Aluminiumchlorid zu erhalten.
Dichte
2.48 g/cm3 (wasserfrei)
2.398 g/cm3 (Hexahydrat)
Wasserlöslichkeit
439 g/l a 0 ºC
458 g/l bei 20 ° C
466 g/l a 30 ºC
Aluminiumchlorid ist eine hygroskopische Verbindung, die feuchtes Luftwasser aufnehmen kann und während des Prozesses einen Rauch ausgibt.
Löslichkeit in anderen Lösungsmitteln
Ethanollösliches, Chloroform, Kohlenstofftetrachlor, Benzofenon und Nitrobenzol. Etwas löslich in Benzol.
Dampfdruck
13.3 kPa bei 151 ºC (0.131 atm).
Schmiere
0.35 CP bis 197 ºC
Reaktivität
Aluminiumchlorid ist eine Amphotat -Substanz, dh es verhält sich wie eine Säure oder eine Base. Seine Wirkung als Säure ist jedoch überwiegend, da Aluminiumchlorid als Lewis -Säure verwendet wird und gleichzeitig ein Katalysator in vielen chemischen Reaktionen ist; Unter ihnen die Reaktion von Friedel-Crafts.
Kann Ihnen dienen: Neodymium: Struktur, Eigenschaften, verwendetSogar Aluminiumchlorid wird als Säure klassifiziert, anstatt es als Salz zu tun.
Wasserfreies Aluminiumchlorid in wässriger Lösung wird in Hexahydratsalz (Alcl3· 6h2O), was durch Erwärmen nicht zur wasserfreien Form zurückkehrt.
Aluminiumatome von zwei ALCL -Molekülen3 Sie interagieren miteinander, um 8 Elektronen in ihrer Valenzschicht zu vervollständigen, was zur Bildung des Dimers an das führt2Cl6. Dieses Dimer ist in geschmolzenem Aluminiumchlorid und Dampf vorhanden.
Aluminiumchlorid reagiert mit Natriumhydroxid, um Aluminiumhydroxid zu bilden, einen gallertartigen Niederschlag:
Alcl3 + NaOH → Al (OH)3 + 3 NaCl
Aluminiumchloridanwendungen
Antitranspirant und Antihämorrhagic
 Aluminiumchlorid ist Teil der Zutaten, die in den Formulierungen mehrerer Deodorants verwendet werden. Quelle: Th145, CC BY-SA 2.0, über Wikimedia Commons
Aluminiumchlorid ist Teil der Zutaten, die in den Formulierungen mehrerer Deodorants verwendet werden. Quelle: Th145, CC BY-SA 2.0, über Wikimedia Commons Aluminiumchlorid wird als Antitranspirant in persönlichen Deodorants verwendet und wird auch verwendet, um übermäßiges Schwitzen zu kontrollieren (Hyperhidrose). Es wird auch in Formulierungen verwendet, um kleine Blutungen zu kontrollieren, wie beispielsweise in Zahnbehandlungen.
Abwasserbehandlung
Aluminiumchlorid in Form von PAC (Polyaluminchlorid) wird als koagulierend bei der Behandlung von industriellem Abwasser verwendet, da er Wasser und Dehydratschlamm klären kann.
Katalysator
Aluminiumchlorid ist einer der Hauptkatalysatoren in der Branche und fungiert als Katalysator bei zahlreichen Reaktionen, einschließlich Friedel-Crafts.
Kann Ihnen dienen: Europium: Struktur, Eigenschaften, erhalten, verwendet, verwendetAluminiumchlorid katalysiert die Zubereitungsreaktionen von Antraquinonen, von denen einige in der Textilindustrie verwendet werden. Es gibt auch Antraquinone mit antibakteriellen, antiparasitären, fungiziden und antiviralen Eigenschaften.
Aluminiumchlorid katalysiert die von Dodecilbenzol, die bei der Herstellung von Reinigungsmitteln herangezogenen Reaktionen, und Ethylbenzol, die bei der Herstellung von Polystyrol, Polymer bei der Ausarbeitung von Plastik, Harzen und Gummi verwendet wird.
Aluminiumchlorid wird auch als Katalysator in einer Reaktion verwendet. Ebenso katalysiert der Öl -Cracking -Prozess.
Risiken
Aluminiumchlorid ist eine korrosiv.
Beim Auflösen im Wasser können giftige Gase freigesetzt werden, wie z. B. Wasserstoffchlorid; Gase, die in der Lage sind, eine Reizung von Nase und Hals einzuatmen, in der Lage zu sein, harte und Lungenreizungen zu verursachen. Diese Reizung kann zur Akkumulation von Flüssigkeit in der Lunge (Lungenödem) führen, die in einem medizinischen Notfall endet.
Es hat versucht, einen Zusammenhang zwischen Alzheimer -Krankheit und Aluminiumchlorid herzustellen. Obwohl die Forschungsergebnisse nicht schlüssig sind.
Ebenso wurde der Zusammenhang zwischen der Verwendung von Deodorants, die sie als Anti -Transpirant mit dem Alll verwenden, untersucht3 und Brustkrebs. Forschung war nicht in der Lage, eine schlüssige Beziehung zu demonstrieren. Aluminiumchlorid blockiert in jedem Fall den Betrieb eines natürlichen Entgiftungssystems des Organismus und der Wärmeemission, z. B. Schweiß.
Verweise
- Wikipedia. (2021). Chloridaluminium. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologieinformationen (2021). Chloridaluminium, Pubchem -Verbindungsübersicht für CID 24012. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- NJ Gesundheit. (2008). Gefährliche Substanz Fact Sheet: Aluminiumchlorid. [PDF]. Erholt von: NJ.Regierung
- Britannica Encyclopaedia. (2021). Chloridaluminium. Erholt von: Britannica.com
- Elsevier b.V. (2021). Anthrachinone. Scientedirect. Abgerufen von: Scientedirect.com
- John p. Cunha. (02. Mai, 2020). Topisches Chloridaluminium. Wiederhergestellt von: rxlist.com

