Calciumchlorid (CACL2)
- 3997
- 427
- Joe Hartwig
Wir erklären, welches Calciumchlorid, seine Struktur, seine physikalischen und chemischen Eigenschaften, wie es synthetisiert und seine Anwendungen ist
Was ist Calciumchlorid?
Er Calciumchlorid (Cacl2) Es ist ein anorganisches Salz, das aus Kalzium, alkalischem Metall und Halogenchlor besteht. In dieser Verbindung gibt es mehrere elektrostatische Wechselwirkungen, die das äußere Erscheinungsbild ihrer Kristalle und den Rest seiner physikalischen Eigenschaften definieren.
Es wird auch von Wassermolekülen begleitet und bildet COCl Allgemeinformel Hydrate2· Xh2Oder mit x = 0, 1, 2, 4 und 6. Wenn x = 0 ist, fehlt dem Salz Wasser und ist anhydrid, wie durch seine oben erwähnte chemische Formel angezeigt.
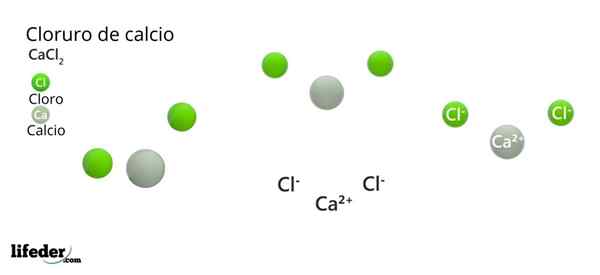
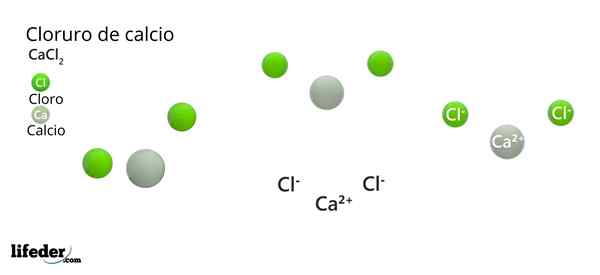
Im überlegenen Bild werden einige feste Teile von CaCl veranschaulicht2. Unter Bedingungen wenig Luftfeuchtigkeit ist es möglich.
Formel
Seine chemische Formel ist CaCl2: Drückt das für jedes CA -Ion aus2+ Es gibt zwei Clionen- das neutralisiert die positive Last. Das Calciummetall -von Gruppe 2 der Periodenzüchter (SR. Scholambara)- ergibt seine beiden Elektronen für jedes Chloratom, Gruppenelement 17.
Calciumchloridstruktur
Im überlegenen Bild wird die CACl -Struktur dargestellt2 Anhydrid. Grüne Kugeln entsprechen Cl -Ionen-, während weiß zu den Ionen ca2+. Diese Kugeln sind in parallelepiped fixiert, was nichts anderes ist als die einheitliche ortorrombische Zelle der Kristalle.
Die Struktur kann die falsche Idee geben, dass Kalzium vorherrscht; Wenn jedoch weitere Wiederholungen der Einheitszelle reproduziert werden, wäre die größte Häufigkeit der grünen Kugeln klar: Die Cl -Ionen-.
Andererseits Ca -Ionen2+ Sie haben kleinere ionische Radios als Cl -Ionen-. Dies liegt daran, dass die Kerne der Atome, wenn sie Elektronen verlieren.
Im Fall des CL-, Dies hat ein zusätzliches Elektron, das nicht von derselben Kraft angezogen werden kann, wodurch der ionische Radius erhöht wird.
Kann Ihnen dienen: wässrige LösungenMolekulare Geometrie und wässrige Calciumkomplexe
In der Mitte der Parallelepiped die CA2+ Es ist von sechs CL umgeben-. Vier dieser liegen in einer quadratischen Ebene und die anderen beiden befinden sich senkrecht (die am weit entfernten grünen Kugeln in der weißen Kugel).
Infolge der Anordnung dieser Ionen um die CA2+ Ein OctAedro ist "Waffe", die so eine oktaedrische molekulare Geometrie zuweist.
Wenn man bedenkt, wie grüne Kugeln angeordnet sind, kann ein Wassermolekül eines davon ersetzen, was beim Schlaganfall auftritt2· H2Oder möglicherweise im quadratischen Flugzeug. Diese Tatsache modifiziert die kristalline Struktur und wenn das Wasser die grünen Kugeln ersetzt, ändert sich die Ionenanordnung mehr.
Wenn alle Clins- Sie werden durch Wassermoleküle ersetzt, das CACl -Hydrat wird gebildet2· 6h2ENTWEDER. Zu diesem Zeitpunkt ist das Oktaeder "wässrig" und die Moleküle können nun durch Wasserstoffbrücken zwischen ihnen interagieren (CA2+ Oh-h-oh2).
Nachfolgend kann Kalzium noch mehr Wassermoleküle akzeptieren, ohne den festgelegten Anteil zu verändern. Dies bedeutet, dass der CaCl2· 6h2Oder kann andere komplexe Strukturen annehmen, bis er kristalline Polymere von Kalzium und Wasser berücksichtigt.
Diese Strukturen sind jedoch weniger stabil als die, die durch elektrostatische Wechselwirkungen errichtet wurde (CA)2+ und Cl-) aus Anhydridsalz.
Verwendet/Anwendungen von Kalziumchlorid
Die Hauptanwendungen von Calciumchlorid sind:
- Vermeiden Sie das Einfrieren von Wasser im Winter. Calciumchlorid erzeugt sehr Wärme beim Auflösen und dann, die Temperatur erhöht, Eisfusion tritt auf. Aus diesem Grund wird es verwendet, um das Risiko der Umlauf der Menschen und Fahrzeuge während der Kaltstation zu verringern.
- Helfen Sie, Staub auf unbefestigten Straßen zu kontrollieren.
- Beschleunigen Sie die Trocknungsgeschwindigkeit von Beton, die einmal gegossen wurde.
- Cachl Flüssigkeiten2 Die Effizienz des Bohrers für die Gasgewinnung aus ihren unterirdischen Ablagerungen steigt sowie Öl.
- Pools werden hinzugefügt, um die Erosion zu verringern, die durch den Beton seiner Wände erlitten wird. Sedimentiertes Kalzium erfüllt diese Funktion.
- Da es sich um ein hygroskopisches Salz handelt, kann Calciumchlorid als Dissens verwendet werden, um die Feuchtigkeit der umgebenden Luft zu senken und daher von Substanzen in Kontakt mit dieser Luft.
- Es wird als Konservierungsmittel in einigen Lebensmitteln sowie als Additiv in mehreren verwendet, wie beispielsweise Energy Drinks von Sportlern, Käse, Bieren usw.
- In der medizinischen Praxis hat es auch Nützlichkeit bei der Behandlung von Depression.
Synthese von Kalziumchlorid
Die natürlichen Quellen dieser Verbindung sind die Salmueras, die aus den Meeren oder den Seen extrahiert wurden.
Die Hauptquelle stammt jedoch aus dem Solvay -Prozess, in dem der Kalkstein (Caco3) Erleiden Sie eine Reihe von Transformationen, bis Calciumchlorid in By -Produkt abgeleitet ist:
2naCl (aq) + Caco3(s) na2CO3(s) + caCl2(Ac)
Das Interesse des Interesses dieses Prozesses ist tatsächlich Natriumcarbonat, NA2CO3.
Eigenschaften von Kalziumchlorid
Physikalische Eigenschaften und Deliszenz
Es ist eine weiße, toilette und hygroskopische Feste. Diese Tendenz, Feuchtigkeit der Umwelt zu absorbieren2+.
Basizität der Art von Lewis oder Bronsted? Lewis, weil die positiven Spezies in der Lage sind, Elektronen zu akzeptieren. Diese Elektronen werden zum Beispiel von Sauerstoffatomen von Wassermolekülen gespendet.
Der Feststoff absorbiert Feuchtigkeit auf den Grad der Auflösung in demselben Wasser, das seine Kristalle benimmt. Diese Eigenschaft ist als DeletCECIA bekannt.
Seine Dichte beträgt 2,15 g/ml. Wenn es Wasser in seine Struktur einbezieht, wird der Kristall „erweitert“, erhöht sein Volumen und verringert folglich die Dichte. Nur der Cacl2· H2O Brechen Sie mit diesem Trend und zeigen eine größere Dichte (2,24 g/ml).
Das Molekulargewicht von anhydrides Salz beträgt ungefähr 111 g/mol, und für jedes Wassermolekül in seiner Struktur erhöht dieses Gewicht 18 Einheiten.
Löslichkeit
Der Kakl2 Es ist sehr löslich in Wasser und in einigen polaren Lösungsmitteln wie Ethanol, Essigsäure, Methanol und anderen Alkoholen.
Wärme Wärme
Wenn der Prozess in Wasser gelöst ist, ist er exotherm und erhitzte daher die Lösung und ihre Umgebung.
Kann Ihnen dienen: Woher kommt Plastik?? Geschichte und TypenDies liegt daran, dass der wässrige Komplex die CA -Ionen besser stabilisiert2+ in Lösung, dass elektrostatische Wechselwirkungen mit Cl -Ionen-. Da das Produkt stabiler ist, setzt der Feststoff Energie in Form von Wärme frei.
Elektrolytische Zersetzung
Der Kakl2 geschmolzen kann einer elektrolyse, physikalischen Prozesse ausgesetzt werden, die in der Trennung einer Verbindung in ihren Elementen von der Wirkung eines elektrischen Stroms besteht. Bei diesem Salz sind die Produkte metallisches Kalzium und gasförmiges Chlor:
CaCl2(l) → Ca (s) + cl2(G)
Die Ionen ca2+ Sie sind in der Kathode reduziert, während Cl -Ionen- Sie werden an der Anode oxidiert.
Verweise
- Wikipedia. (2018). Calciumchlorid. Abgerufen von.Wikipedia.Org
- Shiver & Atkins. (2008). Anorganische Chemie. In Gruppe 2 Elemente. (Vierte Edition., P. 278). Mc Graw Hill.
- Pubchem. (2018). Calciumchlorid. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Oxychem. Calciumchlorid: Ein Leitfaden für physikalische Eigenschaften. Oxy erholt sich.com
- Carole Ann. Häufige Verwendungen von Kalziumchlorid. Hunker erholte sich.com