Kupferchlorid (i) (CUCl) Struktur, Eigenschaften, verwendet
- 2037
- 288
- Ibrahim Steuk
Er Kupferchlorid (i) Es ist eine anorganische Verbindung, die durch Kupfer (Cu) und Chlor (CL) gebildet wird. Seine chemische Formel ist Cucl. Das Kupfer in dieser Verbindung hat Valencia von +1 und das Chlor -1. Es ist ein weißer kristalliner Feststoff, der aufgrund der Oxidation von Kupfer (i) zu Kupfer (ii) eine grünliche Färbung durch die Oxidation von Kupfer (i) erhält (ii), wenn es eine lange Zeit ausgesetzt ist.
Es verhält sich als Lewis -Säure, die Elektronen anderer Verbindungen benötigen, die Lewis -Basen sind, mit denen komplexe oder stabile Addukte bilden. Eine dieser Verbindungen ist Kohlenmonoxid (CO), daher wird die Fähigkeit, sich zwischen ihnen zusammenzuschließen.
 Kupferchlorid (i) (CUCl) gereinigt. Leiem/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons.
Kupferchlorid (i) (CUCl) gereinigt. Leiem/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons. Es verfügt über optische Eigenschaften, die in leichten Halbleitern verwendet werden können. Darüber hinaus haben CuCl -Nanocubes ein großes Potenzial, in effizienten Energiegeräten eingesetzt zu werden.
Es wird in der Kunst der Pyrotechnik verwendet, da in Kontakt mit einer Flamme ein bläuliches grünes Licht erzeugt.
[TOC]
Struktur
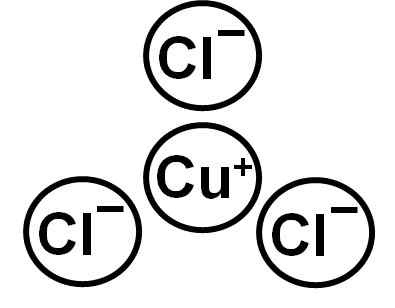
Die CUCL wird vom Cuproso -Becher -Ion gebildet+ und Anionenchlorid CL-. Die elektronische Konfiguration des Ionen Cu+ Ist:
1s2 2s2 2 p6 3s2 3p6 3d10 4s0
Und es liegt daran, dass Kupfer das Elektron der 4S -Schicht verloren hat. Das Chloridion hat die Konfiguration:
1s2 2s2 2 p6 3s2 3p6
Es ist ersichtlich, dass beide Ionen ihre vollständigen elektronischen Schichten haben.
Diese Verbindung kristallisiert mit kubischer Symmetrie. Im Bild unten wird die Anordnung der Atome in einer kristallinen Einheit beobachtet. Rosa Kugeln entsprechen Kupfer und grünen Kugeln zu Chlor.
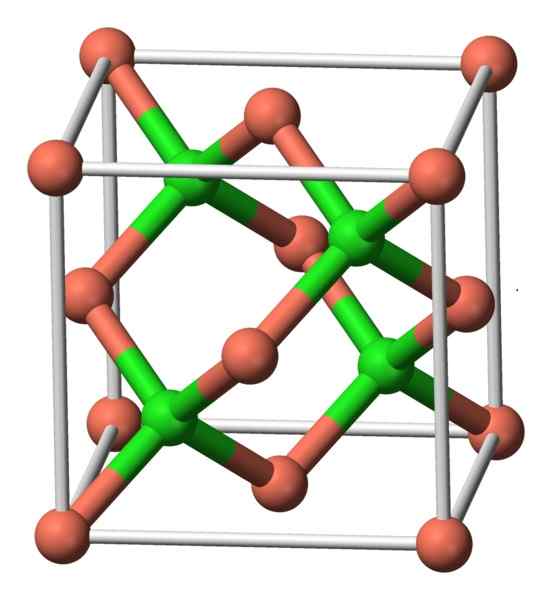 CUCl -Struktur. Autor: Benjah-BMM27. Quelle: Wikimedia Commons.
CUCl -Struktur. Autor: Benjah-BMM27. Quelle: Wikimedia Commons. Nomenklatur
- Kupferchlorid (i)
- Kupplungschlorid
- Kupfermonoklorid
Eigenschaften
Körperlicher Status
Kristalliner weißer Feststoff, der in längerer Luft mit Luft oxidiert wird und grün wird.
Molekulargewicht
98,99 g/mol
Schmelzpunkt
430 ºC
Siedepunkt
Ungefähr 1400 ° C.
Dichte
4,137 g/cm3
Löslichkeit
Fast unlöslich in Wasser: 0,0047 g/100 g Wasser bei 20 ° C. Unlöslich in Ethanol (C2H5OH) und Aceton (wählen3(C = o) ch3).
Es kann Ihnen dienen: Alilo: Allyic Unit, Carbocation, Radical, BeispieleChemische Eigenschaften
Es ist in der Luft instabil, weil Cu+ neigt dazu, Cu zu oxidieren2+. Im Laufe der Zeit wird Cupricoxid (CUO), Cupro -Hydroxid (CUOH) oder ein komplexes Oxychlorid und Salz grün gedreht.
 Kupferchlorid (i), das der Umwelt ausgesetzt und teilweise oxidiert wurde. Cuoh, Cuoh und andere Verbindungen können enthalten. Benjah-BMM27 / Public Domain. Quelle: Wikimedia Commons.
Kupferchlorid (i), das der Umwelt ausgesetzt und teilweise oxidiert wurde. Cuoh, Cuoh und andere Verbindungen können enthalten. Benjah-BMM27 / Public Domain. Quelle: Wikimedia Commons. In wässriger Lösung ist es auch instabil, da gleichzeitig eine Oxidation und eine Reduktionsreaktion auftritt, wodurch metallische Kupfer- und Kupferion (II) bildet:
Cucl → cu0 + Cucl2
Die Cucl als Lewis -Säure
Diese Verbindung wirkt chemisch als Lewis -Säure, was bedeutet, dass sie nach Elektronen bestrebt ist, so dass sie stabile Addukte mit Verbindungen bildet, die sie liefern können.
Es ist sehr löslich in Salzsäure (HCl), wo Clinionen- Sie verhalten sich, wenn Elektronspender und Arten wie Cucl gebildet werden2-, Cucl32- und cu2Cl42-, unter anderem.
 Dies ist eine der Arten, die in den CUCL -Lösungen in HCL gebildet werden. Autor: Marilú Stea.
Dies ist eine der Arten, die in den CUCL -Lösungen in HCL gebildet werden. Autor: Marilú Stea. Wässrige CUCL -Lösungen haben die Fähigkeit, Kohlenmonoxid (CO) zu absorbieren. Diese Absorption kann auftreten, wenn diese Lösungen sowohl sauer als auch neutral oder mit Ammoniak (NH) sind3).
In solchen Lösungen wird geschätzt, dass verschiedene Arten wie Cu (CO) gebildet werden+, Kuckuck)3+, Kuckuck)4+, CUCl (CO) und [Cu (CO) cl2]-, das hängt vom Medium ab.
Andere Eigenschaften
Es hat elektrooptische Eigenschaften, einen geringen optischen Verlust in einem weiten Bereich des Lichtspektrums von sichtbar zu Infrarot, niedrigem Brechungsindex und konstantem dielektrischem Tief.
Erhalten
Kupferchlorid (i) kann erhalten werden, indem das Metallkupfer direkt mit Chlorgas bei einer Temperatur von 450 bis 900 ° C reagiert wird. Diese Reaktion gilt industriell.
2 cu + cl2 → 2 Cucl
Sie können auch eine reduzierende Verbindung wie Ascorbinsäure oder Schwefeldioxid verwenden, um Kupferchlorid (II) an Kupferchlorid zu passen (i). Zum Beispiel im Fall des SO2, Dies wird zu Schwefelsäure oxidiert.
2 cucl2 + SW2 + 2 h2O → 2 cucl + h2SW4 + 2 HCl
Anwendungen
In CO -Recovery -Prozessen
Die Fähigkeit der absorbierenden und Insorber -Lösungen.
Kann Ihnen dienen: TurbidimetrieZum Beispiel verwendet der Prozess, der Cosorb bezeichnet wird, stabilisierter Kupferchlorid in Form eines komplexen Salz4), das sich in einem aromatischen Lösungsmittel wie Toluol auflöst.
Die Lösung absorbiert den CO eines gasförmigen Stroms, um ihn von anderen Gasen wie CO zu trennen2, N2 und Ch4. Dann wird die am Monoxid reichhaltige Lösung unter reduziertem Druck (dh niedriger als der Atmosphäre) erhitzt und der CO ist Exorg. Das auf diese Weise geborgene Gas ist eine hohe Reinheit.
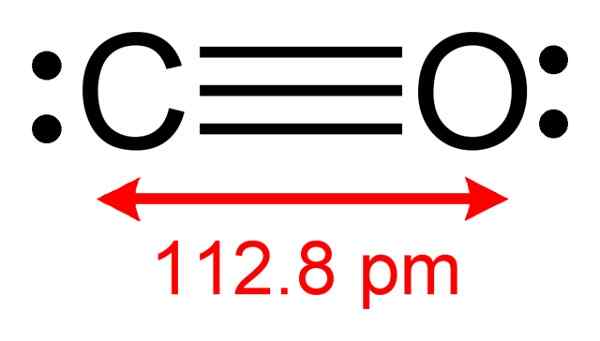 Kohlenmonoxidstruktur, bei der Elektronen zur Bildung von Komplexen mit der CUCL verfügbar sind. Autor: Benjah-BMM27. Quelle: Wikimedia Commons.
Kohlenmonoxidstruktur, bei der Elektronen zur Bildung von Komplexen mit der CUCL verfügbar sind. Autor: Benjah-BMM27. Quelle: Wikimedia Commons. Mit diesem Vorgang können Sie ein reines CO erhalten.
Bei Katalyse
Die CUCL wird als Katalysator für verschiedene chemische Reaktionen verwendet.
Zum Beispiel die Reaktion des Germanio (GE) -Elements mit Wasserstoffchlorid (HCl) und Ethylen (CH)2= Ch2) kann mit dieser Verbindung durchgeführt werden. Es dient auch für die Synthese organischer Siliziumverbindungen und unterschiedlicher heterocyclischer organischer Derivate von Schwefel und Stickstoff.
Sie können ein Polyphenileneter-Polymer unter Verwendung eines 4-Amypirin- und Hockensystems synthetisieren. Dieses Polymer ist sehr nützlich für seine mechanischen Eigenschaften, eine geringe Feuchtigkeitsabsorption, eine hervorragende Isolierung von Elektrizität und Feuerwiderstand.
Bei der Erlangung organischer Kupferverbindungen
Alkenilcupratato -Verbindungen können durch Reaktion eines terminalen Alkys hergestellt werden.
Bei der Erlangung von Polymeren, die zu Metallen vereint sind
Kupferchlorid (i) kann mit Polymeren koordiniert werden, die komplexe Moleküle bilden, die als Katalysatoren dienen und die Einfachheit eines heterogenen Katalysators mit der Regelmäßigkeit eines homogenen Homogen kombinieren.
In Halbleitern
Diese Verbindung wird verwendet, um ein von γ-Corpu auf Silizium gebildeter Material zu erhalten.
Diese Materialien werden bei ultravioletten Lichtdioden, Laserdioden und Lichtdetektoren weit verbreitet.
Kann Ihnen dienen: Kaliumbromid (KBR): Struktur, Eigenschaften, verwendetIn Super Cardpisors
Dieses Produkt, das in Form von Kubik- oder Nanocubes -Nanopartikeln erhalten wurde.
Supercorder sind Geräte zum Speichern von Energie, die sich für ihre hohe Stromdichte, den Betrieb des Betriebs, die schnelle Belastungs- und Entladungszyklen, langfristige Stabilität und umweltfreundlich abheben und umweltfreundlich sind.
 Nanocubos CUCL könnte in Elektronik- und Energiespeicheranwendungen verwendet werden. Autor: Flut er. Quelle: Pixabay.
Nanocubos CUCL könnte in Elektronik- und Energiespeicheranwendungen verwendet werden. Autor: Flut er. Quelle: Pixabay. Andere Apps
Geben.
 Die grüne Farbe einiger Feuerwerkskörper kann auf das Schnarchen liegen. Autor: Hans Braxmeier. Quelle: Pixabay.
Die grüne Farbe einiger Feuerwerkskörper kann auf das Schnarchen liegen. Autor: Hans Braxmeier. Quelle: Pixabay. Verweise
- Milek, j.T. und Neuberger, m. (1972). Chlorid Cuprous. In: lineare elektrooptische modulare Materialien. Springer, Boston, MA. Link wiederhergestellt.Springer.com.
- Blei, d.R. (Herausgeber) (2003). CRC -Handbuch für Chemie und Physik. 85th CRC Press.
- Sneeden, r.P.ZU. (1982). Absorptions-/Diskussionsmethoden. In umfassender organometallischer Chemie. Band 8. Von Scientedirect erholt.com.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Chandrashekhar, v.C. et al. (2018). Jüngste Fortschritte bei der direkten Synthese von organometallischen und Koordinationsverbindungen. In direkter Synthese von Metallkomplexen. Von Scientedirect erholt.com.
- Kyushin, s. (2016). Organosilicon -Synthese zur Konstruktion von Organosilicon -Clustern. In effizienten Methoden zur Herstellung von Siliziumverbindungen. Von Scientedirect erholt.com.
- Van Koten, G. und Noltes, J.G. (1982). Organokoperverbindungen. In umfassender organometallischer Chemie. Band 2. Von Scientedirect erholt.com.
- Danieluk, d. et al. (2009). Optische Eigenschaften von ungetackigen und sauerstoffdotierten Cucl -Filmen auf Siliziumvermietung. J Mater Sci: Mater Electron (2009) 20: 76-80. Link wiederhergestellt.Springer.com.
- Yin, b. et al. (2014). Cupro -Chlorid -Nanocubes, die auf Kupferfehler für Pseudokapacitor -Elektroden gezüchtet wurden. Nano-Micro Lett. 6, 340-346 (2014). Link wiederhergestellt.Springer.com.
- Kim, k. et al. (2018). Ein hocheffizienter aromatischer Aminligand/Kupfer (i) Chlorid. Polymers 2018, 10, 350. MDPI erholt sich.com.
- Wikipedia (2020). Kupfer (i) Chlorid. Abgerufen von.Wikipedia.Org.
- « Molare Fraktion, wie es berechnet wird, Beispiele, Übungen
- Butcrickfett, Typ, Typ, Zusammensetzung, Verwendungen, Vorteile »

