Zinnchlorid (ii)
- 2268
- 445
- Joy Hort
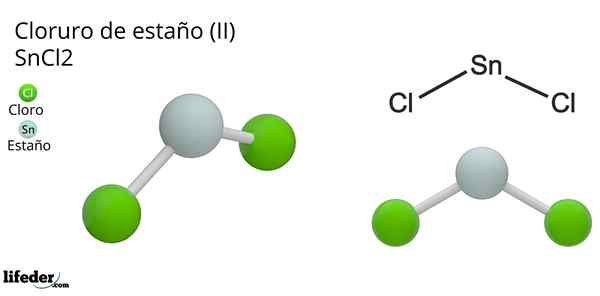
Er Zinnchlorid (Ii) oder winziges Chlorid der chemischen Formel SNCL2, Es ist eine weiße und kristalline feste Verbindung, Produkt der Zinnreaktion und eine konzentrierte Salzsäurelösung2(aq) + h2(G). Der Prozess seiner Synthese (Präparation) besteht darin, Zinnstücke hinzuzufügen, um mit Säure zu reagieren.
Nach dem Hinzufügen der Zinnstücke werden Dehydration und Kristallisation durchgeführt, bis das anorganische Salz erhalten wird. In dieser Verbindung hat die Dose zwei Elektronen ihrer Valenzschicht verloren, um Glieder mit Chloratomen zu bilden.
Dies kann besser verstanden werden, wenn die Konfiguration von Tin Valencia in Betracht gezogen wird (5s25 pX2PUnd0Pz0), von denen das Elektronenpaar, das das Orbital P besetztX wird den Protonen h zugeordnet+, Um ein zweistufiges Wasserstoffmolekül zu bilden. Das heißt, dies ist eine Redoxreaktion.
[TOC]
Zinnchlorideigenschaften
 Zinnchlorid (ii) Dihydrat
Zinnchlorid (ii) Dihydrat SNCL -Links2 Sie sind ionischer oder kovalenter Typ? Die physikalischen Eigenschaften von Zinnchlorid (ii) verwerfen die erste Option. Die Fusions- und Siedepunkte für diese Verbindung betragen 247 ºC und 623 ºC, was auf schwache intermolekulare Wechselwirkungen hinweist, gemeinsame Tatsache für kovalente Verbindungen.
Seine Kristalle sind weiß, was im sichtbaren Spektrum zu einer Nullabsorption führt.
Valencia -Konfiguration
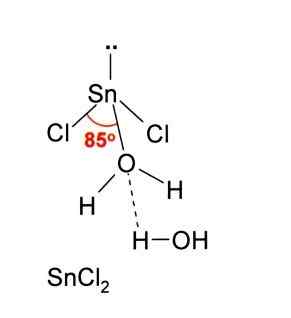
Im obigen Bild wird eine isolierte Münzhäubel Snick veranschaulicht2.
Die molekulare Geometrie sollte flach sein, da die Hybridisierung des zentralen Atoms SP ist2 (3 SP -Orbitale2 und ein reines P -Orbital zur Bildung kovalenter Bindungen), aber das elektronenfreie Drehmoment nimmt Volumen ein und drückt die Chloratome nach unten, wodurch dem Molekül eine Winkelgeometrie verleiht.
In der Gasphase ist diese Verbindung isoliert, sodass sie nicht mit den anderen Molekülen interagiert.
Kann Ihnen dienen: SaponifikationAls Verlust des Elektronenpaars im Orbital pX, Zinn verwandelt sich in das Sn Ion2+ und seine resultierende elektronische Konfiguration beträgt 5s25 pX0PUnd0Pz0, Mit allen Orbitalen verfügbar, um Links von anderen Arten zu akzeptieren.
Clionen- Sie koordinieren mit dem Sn Ion2+ Zinnchlorid hervorrufen. Die elektronische Blechkonfiguration in diesem Salz beträgt 5s25 pX2PUnd2Pz0, in der Lage sein, ein anderes Elektronenpaar in Ihrem freien Orbital P zu akzeptierenz.
Zum Beispiel können Sie ein anderes Ion CL akzeptieren-, Bildung des trigonalen flachen Geometriekomplexes (eine dreieckige Basispyramide) und negativ beladen [SNCL3]-.
Reaktivität
Die SNCL2 Es hat eine hohe Reaktivität und einen hohen Trend, sich als Lewis -Säure (Elektronenrezeptor) zu verhalten, um seinen Valencia -Oktett zu vervollständigen.
Sowie eine Ion CL akzeptieren-, Gleiches gilt für Wasser, das das Zinnatom "hydratiert", wenn ein Wassermolekül direkt mit der Dose verbunden ist, und ein zweites Wassermolekül bildet Wechselwirkungen durch Wasserstoffbrücken mit dem ersten.
Das Ergebnis davon ist, dass die SNCL2 Es ist nicht rein, sondern mit dem Wasser in seinem dihydrierten Salz koordiniert: SNCL2· 2H2ENTWEDER.
Die SNCL2 Es ist sehr löslich in Wasser- und polaren Lösungsmitteln, weil es eine polare Verbindung ist. Seine Löslichkeit im Wasser, weniger als das Massengewicht, aktiviert jedoch eine Hydrolysereaktion (Bruch eines Wassermoleküls), um ein grundlegendes und unlösliches Salz zu erzeugen:
SNCL2(aq) + h2Oder (l) sn (oh) cl (s) + hcl (aq)
Der Doppelpfeil zeigt an, dass ein Gleichgewicht festgelegt wird, der nach links (gegenüber den Reagenzien) bevorzugt wird, wenn die HCL -Konzentrationen zunehmen. Daher SNCL -Lösungen2 Die Mitarbeiter haben einen sauren pH -Wert, um die Ausfällung von unerwünschtem Salzprodukt der Hydrolyse zu vermeiden.
Es kann Ihnen dienen: Nucleophil: nucleophiler Angriff, Typen, Beispiele, NucleophilieReduktive Aktivität
Reagiert mit dem Sauerstoff der Luft, um Zinnchlorid (IV) oder Chlorid zu bilden:
6 SNCL2(aq) + o2(g) + 2h2Oder (l) => 2SNCL4(aq) + 4SN (OH) Cl (s)
In dieser Reaktion oxidiert das Zinn die Verbindung zum elektronegativen Sauerstoffatom und erhöht seine Anzahl an Bindungen mit Chloratomen.
Im Allgemeinen stabilisieren die elektronegativen Atome von Halogenen (F, Cl, Br und I) die Glieder von SN (iv) -Verbindungen, und diese Tatsache erklärt, warum die SNCL2 ist ein Reduktionsmittel.
Wenn sie oxidiert werden und alle seine Valenzelektronen verliert, ist das Sn Ion4+ ist 5S -Konfiguration05 pX0PUnd0Pz0, Als Elektronenpaar im 5S -Orbital ist es am schwierigsten, "weggenommen" zu werden.
Chemische Struktur von Zinnchlorid
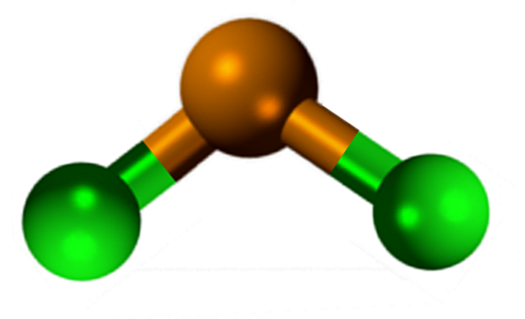 Zinnchloridstruktur (ii)
Zinnchloridstruktur (ii) Die SNCL2 Es präsentiert eine kristalline Struktur des ortorrombischen Typs, ähnlich wie Serhruchos -Reihen, bei denen die Zähnespitzen Chloride sind.
Jede Reihe ist eine SNCL -Kette3 Bilden einer CL-Brücke mit einem anderen SN-Atom (CL-SN (CL)2-Cl- ···). Zwei Ketten, zusammen mit schwachen Wechselwirkungen des SN-C-C-Typs, bilden eine Schicht der Anordnung, die sich über eine andere Schicht überlappt und so weiter, bis das kristalline Feststoff definiert wird.
Das kostenlose Elektronenpaar 5s2 Ursache einer Verzerrung in der Struktur, da sie Volumen einnimmt (das Volumen der elektronischen Wolke).
Die SN kann eine Koordinationsnummer von neun haben, die mit neun Nachbarn entspricht, die ein trigonales Prisma mit diesem in der Mitte der geometrischen Figur und des CL in den Eckpunkten, zusätzlich zu einem anderen CL, der jeweils in jeweils befindet Die Quadratsgesichter des Prismas.
Kann Ihnen dienen: HydraceDies ist leichter zu beobachten, ob es als Kette angesehen wird, in der die SN (dunkelgraue Kugeln) und die drei CL mit dieser Form mit dem dreieckigen Boden verbunden sind, während die drei Kunden das obere dreieckige Dach bilden.
Verwendet/Anwendungen
In der organischen Synthese wird es als Reduktionsmittel von aromatischen Nitroverbindungen (AR-No) verwendet2 à ar-nh2). Da seine chemische Struktur laminar ist, findet sie in der Welt der organischen Reaktionen die Verwendung und ist auch ein potenzieller Kandidat für die katalytische Unterstützung.
Die reduzierende Eigenschaft wird genutzt, um das Vorhandensein von Goldverbindungen zu bestimmen, Glas mit Silberspiegeln zu bedecken und als Antioxidans zu dienen.
Auch in seiner molekularen Geometrie -trigonale Pyramide (: SNX3- M+) wird als Lewis -Basis für die Synthese einer Vielzahl von Verbindungen (wie dem PT -Clusterkomplex3Sn8Clzwanzig, wo das elektronenfreie Paar mit einer Lewis -Säure koordiniert wird).
Risiken
Die SNCL2 Sie können weiße Blutkörperchen beschädigen. Es ist ätzend, irritierend, krebserregend und hat hohe negative Auswirkungen auf die Arten, die Meeresökosysteme bewohnen.
Kann bei hohen Temperaturen zersetzen und das schädliche Chlorgas freigeben. In Kontakt mit sehr oxidierenden Wirkstoffen löst explosive Reaktionen aus.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. In Die Elemente der Gruppe 14 (vierte Edition., P. 329). Mc Graw Hill.
- Chemikalbuch. (2017). Chemikalbuch: Chemikalbuch.com
- Pubchem. (2018). Zinnchlorid. Pubchem geborgen: Pubchem.NCBI.NLM.NIH.Regierung
- Wikipedia. (2017). Zinn (ii) Chlorid. Wikipedia erholte sich: in.Wikipedia.Org
- F. Rumpf. (1976). Strukturchemie der Phasen vom Typ Schicht. P-120,121. D. Reidel Publishing Company.

