Strontiumchlorid (SRCL2)
- 1462
- 159
- Frederike Birkemeyer
Was ist Strontiumchlorid?
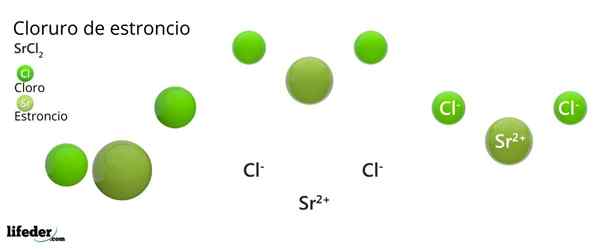
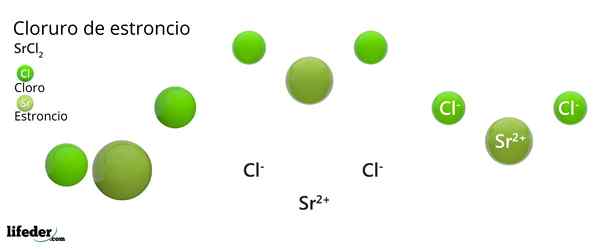
Er Strontiumchlorid Es ist eine anorganische Verbindung, die durch Strontium, Alkalinoterreo Metal (SR) gebildet wird. Becamgbara) und Chlorhalogen. Da beide Elemente sehr unterschiedliche Elektronegativitäten aufweisen, ist die Verbindung ein ionischer Feststoff, dessen chemische Formel SRCL ist2.
Wie ein ionischer Feststoff, besteht es aus Ionen. Im Fall von SRCL2, Sie sind ein SR -Kation2+ Für zwei Anionen cl-. Seine Eigenschaften und Anwendungen ähneln Kalium und Bariumchlorid.
Wie Calciumchlorid (CACL2), ist hygroskopisch und seine Kristalle absorbieren Wasser, um Hexahydratsalz zu bilden, in dem sechs Wassermoleküle im kristallinen Gitter vorhanden sind (SRCL2· 6h2ENTWEDER). Tatsächlich ist die Verfügbarkeit des Hydrats größer als die SRCL2 wasserfrei (ohne Wasser).
Eine seiner Hauptanwendungen ist als Vorläufer anderer Strontiumverbindungen; Das heißt, es ist die Quelle des Strontiums in einer bestimmten chemischen Synthese.
Chemische Struktur von Strontiumchlorid
 Kristallstruktur von Strontiumchlorid
Kristallstruktur von Strontiumchlorid Das übergeordnete Bild repräsentiert den von der SRCL deformierten kristallinen Strukturtyp2 wasserfrei. Darin entsprechen kleine grüne Kugeln SR -Ionen2+, Während die voluminösen grünen Kugeln die Cl -Ionen darstellen-.
In dieser Struktur jedes SR Ion2+ Es wird von acht Cl -Ionen "eingesperrt"-, Folglich eine Koordinationszahl von 8 und möglicherweise eine kubische Geometrie um sie herum haben. Das heißt2+ Im Zentrum.
Was wäre die Soda -Phasenstruktur?? Lewis 'Struktur für dieses Salz ist CL-SR-CL, anscheinend linear und nimmt hundert Prozent seiner Verbindungen an. In einer Gasphase -Srcl jedoch2(g)- Diese "Linie" zeigt einen Winkel von ungefähr 130 °, der tatsächlich eine Art V ist.
Kann Ihnen dienen: gasöser Zustand: Merkmale, allgemeines Recht, BeispieleDiese Anomalie konnte nicht erfolgreich erklärt werden, wenn man bedenkt, dass Strontium keine gemeinsamen Elektronen hat, die das elektronische Volumen einnehmen. Vielleicht kann es durch die Teilnahme eines Orbital-D an den Links oder durch eine Kern-Elektronenstörung verursacht werden.
Verwendet/Anwendungen von Strontiumchlorid
Die SRCL2· 6h2Oder es wurde als Additiv in organischen Polymeren verwendet; Zum Beispiel in Polyvinylalkohol, um seine mechanischen und elektrischen Eigenschaften zu modifizieren.
Es wird als Strontiumferrit bei der Herstellung von Keramik- und Glasmagneten verwendet.
Reagiert mit Natriumchromat (NA)2CRO4) zur Herstellung von Strontiumchromat (SRCRO4), die als korrosionsbeständige Farbe für Aluminium verwendet wird.
Wenn sie mit Feuer erhitzt werden, glänzen Strontiumverbindungen mit einer rötlichen Flamme, weshalb sie zur Ausarbeitung von Fackeln und Feuerwerk bestimmt sind.
Heilanwendungen
Das Radioisotop von Strontiumchlorid 89 (das am häufigsten vorkommende Isotop ist das 85Herr.
Die Verwendung von verdünnten Lösungen (3-5 %) für mehr als zwei Wochen bei der Behandlung von allergischer Rhinitis (chronische Entzündung der Nasenschleimhaut) zeigt Verbesserungen bei der Verringerung des Nasses und des Nasenabs.
Sobald es in dentifrischen Pastenformulierungen verwendet wurde, um die Zahnempfindlichkeit zu verringern und eine Barriere für Dentinal -Mikrotubuli zu bilden.
Studien dieser Verbindung zeigen eine therapeutische Wirksamkeit im Vergleich zu Prednisolon (Prednison -Arzneimittelmetabolit) bei der Behandlung von Colitis ulcerosa.
Es kann Ihnen dienen: Molarenfraktion: Wie es berechnet wird, Beispiele, ÜbungenDie Ergebnisse basieren auf dem Modell der Ratten; Trotzdem ist es die Hoffnung für Patienten, die auch an Osteoporose leiden, da sie zu den gleichen Medikamenten gehen können, um die beiden Krankheiten zu bekämpfen.
Es wird verwendet, um Strontiumsulfat (SRSO) zu synthetisieren4), noch dichterer als der SRCL2. Die minimale Wasserlöslichkeit macht es jedoch nicht leicht genug, um in der Radiologie aufzutreten, im Gegensatz zu Bariumsulfat (Baso4).
Herstellung von Strontiumchlorid
Strontiumchlorid kann durch direkte Wirkung von Salzsäure (HCl) auf reinem Metall hergestellt werden, wodurch eine Redox -Typ -Reaktion auftritt:
MR (S) + HCl (AC) => SRCL2(Ac) + h2(G)
Hier wird das Strontiummetall oxidiert, indem zwei Elektronen gespendet werden, um die Bildung von gasförmigem Wasserstoff zu ermöglichen.
Auch Hydroxid und Strontiumcarbonat (SR (OH)2 und SRCO3) Reagieren Sie mit dieser Säure, indem Sie sie synthetisieren:
SR (OH)2(s) + 2hcl (ac) => srcl2(Ac) + 2h2Oder (l)
SRCO3(s) + 2hcl (ac) => srcl2(ac) + co2(g) + h2Oder (l)
Anwendung von Kristallisationstechniken, SRCL wird erhalten2· 6h2ENTWEDER. Nach dehydratisiert durch thermische Wirkung, bis die SRCL schließlich erzeugt2 wasserfrei.
Strontiumchlorideigenschaften
Die physikalischen und chemischen Eigenschaften dieser Verbindung hängen davon ab, ob sie sich in seiner hydratisierten oder wasserfreien Form befindet. Dies liegt daran2.
Wasserfrei
Strontiumchlorid ist ein weißer kristalline Feststoff mit einem Molekulargewicht von 158,53 g/mol und einer Dichte von 3,05 g/ml.
Die Schmelzpunkte (874 ° C) und das Kochen (1250 ° C) sind hoch, was auf die starken elektrostatischen Wechselwirkungen zwischen den SR -Ionen hinweist2+ und Cl-. Es spiegelt auch die große kristalline retikuläre Energie wider, die seine wasserfreie Struktur hat.
Kann Ihnen dienen: CelluloseacetatSRCL -Bildung Enthalpie2 fest ist 828,85 kJ/mol. Dies bezieht sich auf die thermische Energie, die von jedem Maulwurf freigesetzt wird, der aus seinen Komponenten in seinen Standardzuständen gebildet wurde: Chlor und festes Gas für Strontium.
Hexahydrat
In Form von Hexahydrat hat es ein höheres Molekulargewicht als die wasserfreie (267 g/mol) Form und eine niedrigere Dichte (1,96 g/ml). Diese Abnahme seiner Dichte beruht auf der Tatsache, dass die Wassermoleküle die Kristalle "erweitern" und das Volumen erhöhen; Daher nimmt die Dichte der Struktur ab.
Es ist fast doppelt dicht als Wasser bei Raumtemperatur. Seine Wasserlöslichkeit ist sehr hoch, aber in Ethanol ist es leicht löslich. Dies ist trotz seiner Polarität auf seinen organischen Charakter zurückzuführen. Das heißt, Hexahydrat ist eine anorganische polare Verbindung. Schließlich wird es bei 150 ° C dehydriert, wasser Salz zu erzeugen:
Srcl2· 6h2Oder (s) => srcl2(s) + 6h2O (g)
Verweise
- Wikipedia. (2018). Strontiumchlorid. Abgerufen von.Wikipedia.Org
- Drogenbank. (2018). Strontiumchlorid SR-89. Drogenbank erholt sich.AC
- Pubchem. (2018). Strontiumchlorid. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung
- Stier. Mater. (2010). Einfluss von körnigem Stontiumchlorid als Additive auf die elektrischen und mechanischen Eigenschaften von unterwähnen Polyvinylalkohol. Sci., Vol. 33, Nr. 2, pp. 149-155. Indische Akademie der Wissenschaften.
- Ccoil. (4. September 2009). Stontiumchlorid -xtal-3D-SF. [Figur]. Abgerufen am 13. April 2018 von: Commons.Wikimedia.Org
- Alle Reaktionen. SRCL2 - Stontiumchlorid. Von Allreaktionen geborgen.com