Quecksilberchlorid (ii) Struktur, Eigenschaften, erhalten, verwendet, verwendet

- 4680
- 1498
- Luca Holdt
Er Quecksilberchlorid (II) Es ist eine anorganische Verbindung, die durch ein Atom des Metallquecksilbers (Hg) und zwei Atome des Chlorhalogens (CL) gebildet wird. Quecksilber befindet sich in seinem +2 Oxidationszustand und Chlor -1.
Seine chemische Formel ist HGCL2. Es ist ein leicht flüchtiger kristalline Feststoff bei Raumtemperatur. Gewerkschaften unter ihren Atomen sind kovalenter als ionisch.
 Quecksilberchlorid (II). MRGreen71/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons.
Quecksilberchlorid (II). MRGreen71/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons. Beim Auflösen in Wasser behält es seine molekulare Struktur bei. Es ist auch in mehreren organischen Lösungsmitteln löslich. Durch Licht des Lichts neigt es dazu, metallisches Quecksilber zu bilden.
In der Vergangenheit wurde es als Antiseptikum verwendet und bestimmte Infektionskrankheiten sowohl beim Menschen als auch beim Tieren behandelt. Auch als Insektizid zur Kontrolle von Schädlingen wie Ameisen und Termiten.
Wenn jedoch ihre hohe Toxizität verifiziert wird.
Kann unter bestimmten Bedingungen nutzen. Es ist eine giftige Verbindung, die Menschen, Tieren und Pflanzen schädigen. Es sollte niemals in die Umwelt verworfen werden. Es wird auch verdächtigt, Karzinogen zu sein.
[TOC]
Struktur
Quecksilberchlorid besteht aus Hg in Oxidation II und Chlor mit Valencia -1. In diesem Haluro haben die Verbindungen zwischen den Atomen einen sehr ausgeprägten kovalenten Charakter.
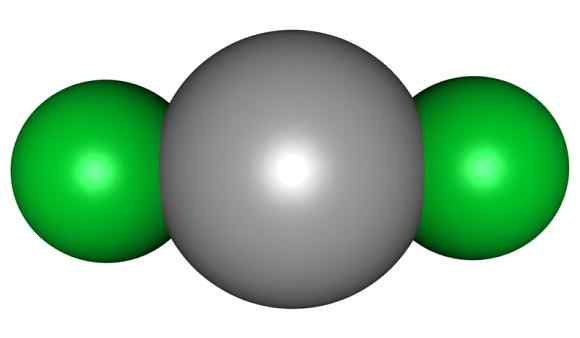 HGCL -Molekül2. Grau = Quecksilber; Grün = Chlor. Pfeilmeister / Public Domain. Quelle: Wikimedia Commons.
HGCL -Molekül2. Grau = Quecksilber; Grün = Chlor. Pfeilmeister / Public Domain. Quelle: Wikimedia Commons. Dies bedeutet, dass die Verbindung im Glas ihre molekulare Struktur Cl-HG-C-CL beibehält, wobei der Hg-Cl-Abstand ähnlich ist, wenn sie sich in einem gasförmigen Zustand befindet, während im Glas die Entfernung mit den Chloratomen anderer Moleküle viel ist Alten.
 HGCL -Moleküleanordnung2 Im Glas. Benjah-BMM27 / Public Domain. Quelle: Wikimedia Commons.
HGCL -Moleküleanordnung2 Im Glas. Benjah-BMM27 / Public Domain. Quelle: Wikimedia Commons. Im gasförmigen Zustand ist es eindeutig molekular und auch in wässriger Lösung.
Nomenklatur
- Quecksilberchlorid (II)
- Mercuric Chlorid
- Quecksilberbichlorid
- Dicloromercurio
Eigenschaften
Körperlicher Status
Weiße kristalline feste, rombische Kristalle.
 Festes Quecksilberchlorid. Leiem/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons.
Festes Quecksilberchlorid. Leiem/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons. Molekulargewicht
271,5 g/mol
Schmelzpunkt
280 ºC
Sublimationspunkt
Bei 300 ° C Sublima geht es direkt aus Gasfest.
Dichte
5,6 g/cm3
Löslichkeit
Little wasserlöslich: 7,31 g/100 ml bei 25 ° C. Alkohollöslich: 33 g/ 100 ml bei 25 ° C. Ethylacetat löslich. Wenig löslich im Ether: 4 g/100 ml. Etwas Lösliches in Benzol.
Es kann Ihnen dienen: Helmholtz freie Energie: Einheiten, wie es berechnet wird, gelöste ÜbungenpH
Eine Lösung von 0,2 Mol/l hat einen pH-Wert von 3,2-4,7.
Chemische Eigenschaften
In wässriger Lösung befindet sich fast ausschließlich (∼ 99%) in Form eines HGCL -Moleküls2. Es erleidet jedoch einige Hydrolyse:
Hgcl2 + H2Oder ⇔ hg (oh) cl + h+ + Cl-
Hgcl2 + 2 h2Oder ⇔ hg (OH)2 + 2 h+ + 2 Cl-,
Es präsentiert eine deutliche Löslichkeit in organischen Lösungsmitteln, wo es in Form von Dimeren, dh zwei gebundene Moleküle.
In Gegenwart organischer Substanz und durch Wirkung von Sonnenlicht ist es reduziert, Quecksilberchlorid (I) (HGCL) und dann metallisches Quecksilber zu formen.
Hgcl2 + Sonnenlicht → Hgcl → Hg0
Mit Natriumhydroxidlösung (NaOH) erzeugt ein gelber Präzipitat (HGO) gelb vorkräftig (HGO).
Es ist inkompatibel oder reagiert mit Formen, Sulfiten, Phosphaten, Sulfiden, Gelatine, Albumin, Alkalien, Ammoniak, Calciumhydroxid, Bromiden, Carbonaten, Eisen, Kupfer, Blei, Silbersalzen und einigen Pflanzenmaterialien.
Andere Eigenschaften
Unter anderem in seinem kovalentesten als ionischen Charakter ist es bei Raumtemperatur leicht flüchtig und bei 100 ° C merklich flüchtig.
Erhalten
Sie können oxidierende Metallic Quecksilber (HG) vorbereiten0) mit Chlorgas (CL)2). Beim Erhitzen und Erreichen von mehr als 300 ° C erscheint eine Flamme und ein Dampf, der gesammelt wird2.
Hg + Cl2 + Hitze → Hgcl2
Es wird auch durch Erhitzen von Quecksilbersulfat (II) mit Natriumchlorid erhalten. HGCL -Dämpfe2 Dieser Subliman wird gesammelt und zu einem kristallinen Feststoff kondensiert.
Hgso4 + 2 NaCl → Hgcl2 + N / A2SW4
Die Reaktion zwischen Quecksilberoxid (II) mit Salzsäure in stöchiometrischen Mengen erzeugt HGCL -Kristalle2 Wenn das Medium abgekühlt ist.
HGO + 2 HCl → HGCL2 + H2ENTWEDER
Kristalle können durch Rekristallisation und Sublimation gereinigt werden.
Anwendungen
In chemischen Labors
Es wird als Reagenz in verschiedenen chemischen Analysen verwendet. Es ermöglicht die Herstellung anderer Quecksilberverbindungen wie Quecksilber -Iodid (II), Quecksilberoxid (II), Quecksilberchlorid (I), Ammonium und Quecksilberchlorid (II).
Kann Ihnen dienen: Fluorid: Anamnese, Eigenschaften, Struktur, Erhalten, Risiken, verwendetIn Pathology Laboratories
Es ist Teil der Essiglösung von Zenker, die zur Behandlung von Proben oder Proben von Knochenmarkbiopsien verwendet wird. Die Gewebe werden schnell mit ausgezeichneten histologischen Details eingestellt, die mit dem Mikroskop beobachtet werden müssen.
 Manchmal hgcl2 Es wird in Pathology Laboratories verwendet. Autor: Ernesto Eslava. Quelle: Pixabay.
Manchmal hgcl2 Es wird in Pathology Laboratories verwendet. Autor: Ernesto Eslava. Quelle: Pixabay. Verlassene Verwendung
Im Mittelalter und bis zum Beginn des XX wurde es in verschiedenen Anwendungen verwendet, da seine schädliche Wirkung auf die Gesundheit unbekannt war.
- Als Behandlung bestimmter Krankheiten topisch antiseptisch und desinfektionsmittel.
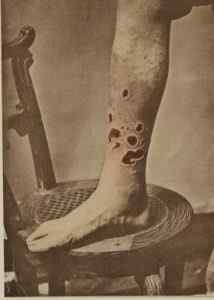 In der Vergangenheit Hgcl2 Es wurde zur Behandlung von Syphilis verwendet. G. H. Fuchs / Public Domain. Quelle: Wikimedia Commons.
In der Vergangenheit Hgcl2 Es wurde zur Behandlung von Syphilis verwendet. G. H. Fuchs / Public Domain. Quelle: Wikimedia Commons. - In der Veterinärmedizin als ätzendes, desinfektes und antiseptisches Mittel.
- In der Landwirtschaft fungierte er als Fungizid, um Landwürmer wie Insektizid und Abstoßung von Kakerlaken, Ameisen und Termiten sowie als Desinfektionsmittel zum Schutz von Samen und Zwiebeln zu kontrollieren.
- Zur Holzerhaltung, chemischer Mittel zum Einbalsamieren und Erhalt von anatomischen Proben.
- Als Katalysator bei der Erlangung von Vinylchlorid aus Acetylen.
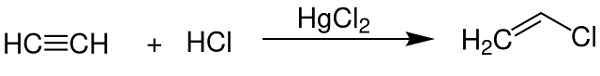 Quecksilberchlorid (ii) dient als Katalysator für die Erlangung einiger chemischer Verbindungen. Chem SIM 2001 / Public Domain. Quelle: Wikimedia Commons.
Quecksilberchlorid (ii) dient als Katalysator für die Erlangung einiger chemischer Verbindungen. Chem SIM 2001 / Public Domain. Quelle: Wikimedia Commons. - In Aluminiumelektrode.
- Eisen und Stahl markieren.
- Als Fotografie -Reagenz.
- Im Stoffdruck als unter anderem für Kaninchen- und Rizinusfell für Holzfarbstoff.
- Als Komponente von getrockneten Batterien.
Risiken
Für die Gesundheit
Es ist eine ätzende und extrem giftige Verbindung, wenn sie aufgenommen wird, da sie den Tod verursachen kann. Greift den Magen -Darm -Trakt und das Nierensystem an. Auf Haut und Augen schwere Verbrennungen verursachen.
Eine verlängerte oder wiederholte Exposition gegenüber dieser Verbindung führt zu einer Schädigung der inneren Organe. Alle Formen des Quecksilbers sind giftig und die HGCL2 ist einer der giftigsten.
Es wird vermutet, dass es Karzinogen ist, was genetische Defekte und Schäden an der Fruchtbarkeit verursacht.
Feuergefahr
Obwohl es sich nicht um Kraftstoff handelt, kann es beim Auftragen von Wärme explodieren. Wenn es giftige und giftige Quecksilbergase abbricht.
HGCL -Mischungen2 Bei alkalischen Metallen wie Natrium oder Kalium reagieren sie sehr empfindlich gegenüber Schlägen und können mit den Auswirkungen ausnutzen. Wenn Sie mit Ammoniak in Kontakt kommen, können Sulfide, Oxalsäure und Acetylen ebenfalls explodieren.
Kann Ihnen dienen: Salzsäure (HCL)Auswirkungen auf die Umwelt
Es ist sehr giftig für Wasser- und Landorganismen, seine Auswirkungen dauern im Laufe der Zeit. Es kann eine Bioakkumulation in der gesamten Nahrungskette aufweisen, sowohl in Pflanzen als auch in Tieren.
 Mercuric Chlorid sollte niemals in der Umwelt verworfen werden. Autor: Naadjuuh. Quelle: Wikimedia Commons.
Mercuric Chlorid sollte niemals in der Umwelt verworfen werden. Autor: Naadjuuh. Quelle: Wikimedia Commons. Es beeinflusst die Atmung, die Photosynthese und andere Stoffwechselwege von Pflanzen, die ihre Verschlechterung verursachen. Seine Disposition in der Umwelt (weder Wasser noch Böden oder Atmosphäre) sollte nicht betroffen sein).
Gefährliche Präsenz bei einigen natürlichen Heilmitteln
Trotz seiner Toxizität gibt es natürliche Heilmittel und Kräuter, die sie enthalten, so dass Menschen, ohne es zu wissen, gefährlich dieser Verbindung ausgesetzt sind.
Zum Beispiel enthält in der traditionellen chinesischen Medizin Calomel oder Qing Fen einige HGCL2. Es handelt.
 Einige UN -kontrollierte natürliche Medikamente können HGCL enthalten2. Autor: Silvija Wesen. Quelle: Pixabay.
Einige UN -kontrollierte natürliche Medikamente können HGCL enthalten2. Autor: Silvija Wesen. Quelle: Pixabay. Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Mercuric Chlorid. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Lester, s.C. (2010). Probenverarbeitung. Zenkers Essigner Fixiermittel (Orange). Im Handbuch der chirurgischen Pathologie (dritte Ausgabe). Von Scientedirect erholt.com.
- Clarksson, t.W. (2001). Agenten. Physikalische und chemische Eigenschaften. In Handbook of Peticid Toxicology (zweite Ausgabe). Von Scientedirect erholt.com.
- Fretham, s.J.B. et al. (2015). Quecksilber und Neurodegeneration. Natürliche Heilmittel und Kräuter mit Hg. In bioaktiven Nährstoff- und Nahrungsergänzungsmitteln bei neurogischen und Hirnerkrankungen. Von Scientedirect erholt.com.
- Ritter, s. et al. (2014). Verteilung und Fülle von Wasserpflanzen - menschliche Auswirkungen. Chemische Polutanten. In Referenzmodulation in Erdsystemen und Umweltwissenschaften. Von Scientedirect erholt.com.
- Blei, d.R. (Herausgeber) (2003). CRC -Handbuch für Chemie und Physik. 85th CRC Press.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Ciavatta, l. und Grimaldi, m. (1968). Die Hydrolyse von Quecksilber (II) Chlorid, HGCL2. Journal of Inorganic and Nuclear Chemistry, Band 30, Ausgabe 2, Februar 1968, Seiten 563-581. Von Scientedirect erholt.com.
- Wikimedia Foundation (2020). Quecksilber (ii) Chlorid. Abgerufen von.Wikipedia.Org.
- « 21 mexikanische Wissenschaftler und ihre historischen Beiträge
- Quecksilberfulminatstruktur, Eigenschaften, erhalten, verwendet, verwendet »

