Bleichlorideigenschaften, Struktur, verwendet

- 3963
- 529
- Luca Holdt
Er Chlorid führen Es ist ein anorganisches Salz, dessen chemische Formel PBCL istN, Wobei n die Oxidationszahl der Führung ist. Wenn also das Blei wie +2 oder +4 ist, ist Salz PBCL2 oder pbcl4, bzw. Daher gibt es zwei Arten von Chloriden für dieses Metall.
Von den beiden die PBCL2 Es ist das wichtigste und stabilste; während die PBCL4 ist instabil und von weniger nützlich. Das erste ist ionischer Natur, wo das Kation PB2+ erzeugt elektrostatische Wechselwirkungen mit dem Cl -Anion- ein kristallines Netzwerk bauen; Und das zweite ist kovalent, mit PB-Cl-Links, die ein Blei und ein Chlor-Tetraeder entstehen.
 Ausgefällte PBCL2 -Nadeln. Quelle: Rrausch1974 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Ausgefällte PBCL2 -Nadeln. Quelle: Rrausch1974 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Ein weiterer Unterschied zwischen Bleichloriden besteht darin, dass PBCL2 Es ist ein Feststoff aus weißen Glas -verdrängten Kristallen (überlegenes Bild); während die PBCL4 Es ist ein gelbliches Öl, das bei -15ºC kristallisieren kann. PBCL -Eingabe2 Es ist ästhetischer als die PBCL4.
Zusätzlich zu den oben genannten PBCL2 Es ist in der Natur als Cotunite -Mineral; während die PBCL4 Nein, da es anfällig für Zerlegungen ist. Während von PBCL4 Sie können den PBO bekommen2, der PBCL2 Sie leiten eine endlose Vielzahl von organomethalischen Verbindungen ab.
[TOC]
Eigenschaften
Die Eigenschaften von Bleichlorid hängen von der Oxidationszahl der Blei ab; Da sich Chlor nicht ändert, sondern die Art und Weise, wie es mit Blei interagiert. Daher müssen beide Verbindungen angesprochen werden; Bleichlorid (ii) einerseits und Bleichlorid (iv) andererseits.
-Bleichlorid (II)
Molmasse
278,10 g/mol.
Aussehen
Weiß gefärbte Kristalle mit Nadelformen.
Dichte
5,85 g/ml.
Schmelzpunkt
501ºC.
Siedepunkt
950ºC.
Wasserlöslichkeit
10,8 g/l bei 20ºC. Es ist wenig löslich und das Wasser muss erhitzt werden, damit eine beträchtliche Menge gelöst werden kann.
Es kann Ihnen dienen: Nickelhydroxid (ii): Struktur, Eigenschaften, Verwendungsmöglichkeiten, RisikenBrechungsindex
2.199.
Bleichlorid (iv)
Molmasse
349.012 g/mol.
Aussehen
Gelbliche ölige Flüssigkeit.
Dichte
3,2 g/ml.
Schmelzpunkt
-15ºC.
Siedepunkt
50ºC. Bei höheren Temperaturen wird das Gaschlor abgebaut:
PBCL4(s) => pbcl2(s) + cl2(G)
Tatsächlich kann diese Reaktion sehr explosiv sein, daher wird PBCL gespeichert4 In Schwefelsäure bei -80ºC.
Struktur
-Bleichlorid (II)
Zunächst wurde erwähnt, dass die PBCL2 Es ist eine ionische Verbindung, daher besteht sie aus PB -Ionen2+ und Cl- Das baut einen Kristall auf, in dem ein PB -Verhältnis festgelegt ist: CL gleich 1: 2; Das heißt, es gibt doppelt so gut wie Clanionen- Welche Kationen PB2+.
Das Ergebnis ist, dass orthorrombische Kristalle gebildet werden, deren Ionen wie im unteren Bild mit einem Kugeln und Balkenmodell dargestellt werden können.
 Cotunit -Struktur. Quelle: Benjah-BMM27 [Public Domain].
Cotunit -Struktur. Quelle: Benjah-BMM27 [Public Domain]. Diese Struktur entspricht auch der des Cotunite -Minerals. Obwohl die Balken verwendet werden, um eine Direktionalität des ionischen Gliedes anzuzeigen, sollte sie nicht mit einer kovalenten (oder zumindest rein kovalenten) Verbindung verwechselt werden).
In den ortorrombischen Kristallen der PB2+ (Grillian Sphären) Es hat neun cl- (grüne Kugeln) um ihn herum, als wäre er in einem dreieckigen Prisma eingesperrt. Für das komplizierte der Struktur und die niedrige ionische Dichte der Pb2+, Die Moleküle sind schwierig, das Glas zu lösen; Grund, warum es in kaltem Wasser wenig löslich ist.
Gasphasenmolekül
Wenn weder der Kristall noch die Flüssigkeit hohen Temperaturen widerstehen können, beginnen die Ionen als PBCl -Moleküle zu verdampfen2 diskret; Das heißt, mit CL-PB-CL-kovalenten Bindungen und einem Winkel von 98 °, als wäre es ein Boomerang. Dann wird gesagt, dass die Gasphase aus diesen PBCL -Molekülen besteht2 und nicht von Ionen, die von Luftströmungen getragen werden.
Kann Ihnen dienen: ElektronegativitätBleichlorid (iv)
Inzwischen die PBCL4 Es ist eine kovalente Verbindung. Weil? Weil das Kation PB4+ Es ist kleiner und hat auch eine größere Ionenlastdichte als die PB2+, Dies führt zu einer stärkeren Polarisierung der elektronischen Wolke des CL-. Das Ergebnis ist, dass anstelle einer Wechselwirkung des ionischen Typs PB4+Cl-, Der kovalente PB-CL-Link wird gebildet.
In Anbetracht dessen wird die Ähnlichkeit zwischen der PBCL verstanden4 Und zum Beispiel die CCL4; Beide werden als tetraedrische einzelne Moleküle dargestellt. Somit wird erklärt, warum dieses Bleichlorid unter normalen Bedingungen ein gelbliches Öl ist; Die Atome von CL sind einige miteinander verbunden und "rutschen", wenn zwei PBCl -Moleküle4 Sie kommen.
Wenn jedoch die Temperatur abfällt und die Moleküle langsamer werden, sind die Wahrscheinlichkeit und die Auswirkungen von Instant -Dipole erhöht (PBCL4 Es ist apolar, da es seine Symmetrie hat); Und dann friert das Öl als gelbe hexagonale Kristalle ein:
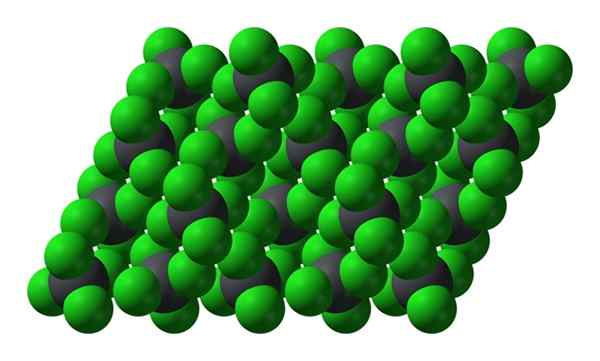 Kristalline Struktur von PBCL4. Quelle: Benjah-BMM27 [Public Domain]
Kristalline Struktur von PBCL4. Quelle: Benjah-BMM27 [Public Domain] Beachten Sie, dass jede graue Kugel von vier grünen Kugeln umgeben ist. Diese PBCL -Moleküle4 "Squeered" bilden einen instabilen Kristall und anfällig, um kräftig zu zersetzen.
Nomenklatur
Die Namen: Bleichlorid (ii) und Bleichlorid (iv) entsprechen denen, die gemäß der Aktiennomenklatur zugewiesen wurden. Da die Oxidationszahl +2 die kleinste für Blei ist und +4 die größten, können beide Chloride nach der traditionellen Nomenklatur als Plumbosechlorid benannt werden (PBCL2) und plúbisches Chlorid (PBCL4), bzw.
Und schließlich ist die systematische Nomenklatur, die die Anzahl jedes Atoms der Verbindung hervorhebt. So die PBCL2 Es ist Bleidichlorid und PBCL4 Blei Tetrachlorid.
Es kann Ihnen dienen: Chemische undurchdringliche UneinigkeitAnwendungen
Eine praktische Verwendung für PBCL ist nicht bekannt4 Zusätzlich zum Servieren der PBO -Synthese2. Die PBCL2 Es ist nützlicher und deshalb werden nur einige Verwendungen für dieses spezifische Lead -Chlorid unten aufgeführt:
- Aufgrund seiner stark leuchtenden Natur ist es für fotografische, akustische, optische und Strahlungsdetektoren bestimmt.
- Nicht in der Region Infrarotspektrum absorbieren, wird es zur Herstellung von Glas verwendet, die diese Art von Strahlung übertragen.
- Er war Teil dessen, was sie als Aureno -Glas nennen, ein attraktives Material der schillernden bläulichen Farbfärbungen, die für dekorative Zwecke verwendet werden.
- Nach dem Kunststhema, wenn Sie erreicht sind, PBCL2· PB (OH)2 erwirbt intensive weißliche Farbtöne mit weißem Bleipigment. Die Verwendung wurde jedoch aufgrund ihrer hohen Toxizität entmutigt.
- Geschmolzen und gemischt mit Bariumtitanat, Batio3, entsteht die Titanato -Keramik von Barium und Ba Ba1 - xPbXOnkel3. Wenn ein Pb2+ Geben Sie den Batio ein3, Ein ba2+ Sie müssen das Glas verlassen, um seine Eingliederung zu ermöglichen, und es wird dann gesagt, dass ein Kationenaustausch auftritt. Deshalb die Zusammensetzung des BA2+ Es wird als 1-x ausgedrückt.
- Und schließlich von PBCL2 Mehrere organomethalische Verbindungen der allgemeinen Formel Rumula werden synthetisiert r4Pb oder r3PB-PBR3.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Blei (ii) Chlorid. Abgerufen von: in.Wikipedia.Org
- Chemische Formulierung. (2019). Bleichlorid (iv). Wiederhergestellt von: Quimica -Formulierung.com
- Clark Jim. (2015). Die Chloride von Kohlenstoff, Silizium und Blei. Erholt von: Chemguide.CO.Vereinigtes Königreich
- Spektrale und optische nichtlineare Studien zu Bleichlorid (PBCL2) Kristalle. [PDF]. Erholt von: Shodhganga.Infibnet.AC.In
- Nationales Zentrum für Biotechnologie Information. (2019). Chlorid führen. Pubchem -Datenbank; CID = 24459. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- « Manganchlorideigenschaften, Struktur, Verwendungen, Risiken
- Die Konvertierung kostet die Berechnung und Beispiele »

