Zinkchlorid (ZNCL2) -Struktur, Eigenschaften, erhalten, verwendet, verwendet

- 1064
- 28
- Luca Holdt
Er Zinkchlorid Es ist eine anorganische Verbindung, die vom Zink- oder Zinkelement (Zn) und Chlor (CL) gebildet wird. Seine chemische Formel ist ZnCL2. CINC findet sich im Oxidationszustand +2 und Chlor hat eine Valencia von -1.
Es ist ein farbloser oder weißer kristalline Feststoff. Es ist sehr löslich in Wasser und absorbiert es leicht aus der Umgebung, was in der Figur des unten gezeigten angefeuchteten Feststoffs zu sehen ist.
 Fifcl Chlorid2 solide etwas hydratisiert. Benutzer: Walkerma / Public Domain. Quelle: Wikimedia Commons.
Fifcl Chlorid2 solide etwas hydratisiert. Benutzer: Walkerma / Public Domain. Quelle: Wikimedia Commons. Das Zink dieser Verbindung ist biologisch sehr wichtig für Menschen, Tiere und Pflanzen, da sie in grundlegenden Funktionen wie Protein und Fettsynthese interveniert.
Aus diesem Grund die ZnCL2 Es wird als Ernährungsergänzung zu Tieren und Menschen bei Zinkmangel und als Mikronährstoff für Pflanzen verwendet.
Es hat bakteriostatische und adstringierende Eigenschaften und wird für diese Zwecke sowohl in der menschlichen als auch in der Veterinärmedizin häufig verwendet. Eliminiert auch Schädlinge wie Outdoor -Pilze und ist ein Vermittler, um Pestizide zu erhalten.
Unter seinen mehreren Verwendungen dient es zur Behandlung von Cellulose- und Wollfasern in verschiedenen Prozessen sowie die Vorbereitung auf Farbe oder Druck. Verzögern Sie auch die Verbrennung von Holz.
[TOC]
Struktur
Die Zncl2 Es ist eine ionische Verbindung, die vom Zn -Kation gebildet wird2+ und zwei Anionen Chlorid CL- das bin durch elektrostatische Kräfte.
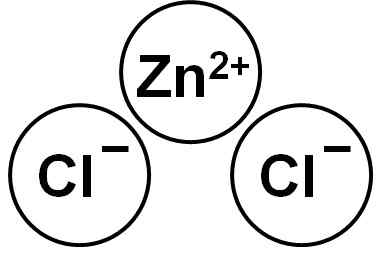 Zinkchlorid. Autor: Marilú Stea.
Zinkchlorid. Autor: Marilú Stea. Das Zink (ii) -Ion hat die folgende elektronische Struktur:
1s2, 2s2 2 p6, 3s2 3p6 3d10, 4s0,
in dem beobachtet wird, dass beide Elektronen des Umhangs 4s, wobei die Konfiguration stabil ist.
Das Chloridion zeigt die folgende Struktur:
1s2, 2s2, 2 p6, 3s2 3p6,
Das ist auch sehr stabil, um vollständige Orbitale zu haben.
In der Abbildung kann die Art und Weise beobachtet werden, wie die Ionen im Glas verfügbar sind. Graue Kugeln repräsentieren Zink- und grüne Kugeln in Chlor.
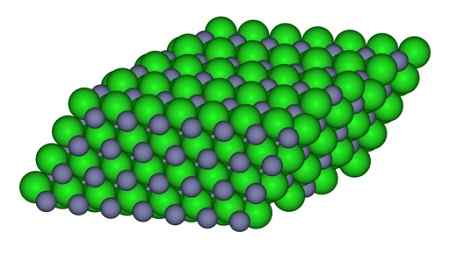 Struktur, die die Ionen im ZnCL -Kristall bildet2. CCOIL/CC BY-SA (https: // creativeCommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons.
Struktur, die die Ionen im ZnCL -Kristall bildet2. CCOIL/CC BY-SA (https: // creativeCommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons. Nomenklatur
- Zinkchlorid (II)
- Zink -Dichlorid
Eigenschaften
Körperlicher Status
Farbloser fester oder kristalline Weiß. Sechskantkristalle.
Molekulargewicht
136,3 g/mol
Schmelzpunkt
290 ºC
Siedepunkt
732 ºC
Dichte
2.907 g/cm3 bei 25 ° C
Löslichkeit
Sehr löslich in Wasser: 432 g/100 g h2Oder bei 25 ° C, 614 g/100 g H2Oder 100 ° C. Sehr löslich in Salzsäure (HCL), Alkohol und Glycerin. Total mischbar.
Kann Ihnen dienen: Quecksilberhydroxid: Struktur, Eigenschaften, Verwendungen, RisikenpH
Seine wässrigen Lösungen sind sauer. Eine Lösung von 6 Mol ZnCL2/L hat einen pH von 1,0.
Chemische Eigenschaften
Es handelt. In Wasser ist es hydrolysiert und hat die Tendenz, eine grundlegende unlösliche Zinkoxychlorid zu bilden.
Reagiert mit Zinkoxid (ZnO) in Wasser, das Zinkoxychloride erzeugt, die ein extrem hartes Zementmaterial ausmachen.
Es ist sanft ätzend gegenüber Metallen.
Es ist nicht brennbar.
Biologische Rolle
Biologisch Zink ist eines der wichtigsten Elemente. Es wurde für alle Lebensweisen als wesentlich anerkannt.
Im menschlichen Körper die ZnCL2 Zn liefert, was für Protein-, Cholesterin- und Fettsynthese essentiell ist. Insbesondere CINC ist wichtig für die ordnungsgemäße Funktion des Immunsystems.
 Der Zink Zncl2 Es ist wichtig für die Zellteilung in Lebewesen. Ladyofhats / Public Domain. Quelle: Wikimedia Commons.
Der Zink Zncl2 Es ist wichtig für die Zellteilung in Lebewesen. Ladyofhats / Public Domain. Quelle: Wikimedia Commons. Es wurden mehr als 25 Proteine, die Zink enthalten.
CINC -Mangel kann zu Wachstum, depressive geistige Funktion, Anorexie, Dermatitis, Abnahme der Immunität, Durchfall und schlechter Nachtsicht führen, unter anderem.
Erhalten
Kommerziell wird diese Verbindung hergestellt, indem wässrige Salzsäure mit Schrott, Zinkabfall oder mit dem Mineral reagiert wird, das sie enthält. In dieser Reaktion gibt es auch Gaswasserstoff (H)2).
Die Behandlung von Zink mit Wasserstoffchlorid bei 700 ° C wird erhalten.
Zn + HCl → ZnCL2 + H2↑
Anwendungen
In therapeutischen Behandlungen
Es ist ein weiches oder bakteriostatisches antibakteriell. Es dient auch dazu.
Es wird als adstringierend in einigen Kosmetika wie erfrischenden Lotionen für die Haut verwendet.
Als Nährwertung
Wegen seiner Bedeutung für verschiedene Funktionen des menschlichen Organismus der ZnCL2 Es wird oral als Teil von Ernährungszubehör und auch bei Menschen verabreicht, die parenterale Lebensmittel benötigen.
ZnCL -Ergänzungen2 Sie werden zur Behandlung der Zone geliefert.
Kann Ihnen dienen: homogene Mischung ZnCL -Ergänzungen2 Sie sollten verwendet werden, wenn Zinkmangel vorliegt. Autor: Moakets. Quelle: Pixabay.
ZnCL -Ergänzungen2 Sie sollten verwendet werden, wenn Zinkmangel vorliegt. Autor: Moakets. Quelle: Pixabay. Gesunde Personen erwerben es durch Lebensmittel.
Es sollte mindestens 1 Stunde vor den Mahlzeiten oder 2 Stunden danach geliefert werden, da einige Lebensmittel ihre Absorption verhindern können. Bei Patienten mit Magenreizungen nach der Ergänzung sollte es mit den Mahlzeiten einnehmen, aber auf diese Weise ist das Zink weniger biologischispononisch.
In Tierärzten
Seine Lösungen wurden bei Tieren als ätzendes Mittel zum Verbrennen oder Kesselfisteln verwendet, die Verbindungen zwischen Organen sind, die nicht normal oder gesund sind. In Form von Pasta dient die Behandlung von Geschwüren und Krebschemotherapie.
 Die wässrigen Lösungen von ZnCL2 Sie werden verwendet, um tierische Augeninfektionen zu behandeln. Autor: Mabel Amber. Quelle: Pixabay.
Die wässrigen Lösungen von ZnCL2 Sie werden verwendet, um tierische Augeninfektionen zu behandeln. Autor: Mabel Amber. Quelle: Pixabay. Bei Augeninfektionen wirkt eine sehr verdünnte Lösung dieser Verbindung als antiseptisch und adstringierend.
Es wird auch als Spuren im Tierfutter oder als Nahrungsergänzungsmittel verwendet.
In speziellen Zementen
Die Reaktion zwischen dem ZnCL2 Und das Zno in Wasser erzeugt Zinkoxychlorid, die ein extrem hartes oder zementmaterial ausmachen. Die Hauptbestandteile sind 4ZNO • ZnCL2• 5H2O und Zno • Zncl2• 2H2ENTWEDER.
Diese Art von Zementen widersteht dem Angriff von Säure oder kochendem Wasser. Das Pentahydrat ist jedoch sehr stabil und unlöslich, aber unveränderlich, und das Dihydrat ist löslicher und kann flüssige Entwässerung verursachen.
Aus diesen Gründen haben diese Zemente nur wenige Anwendungen.
Als Katalysator
Es dient dazu, einige organische Chemiereaktionen zu beschleunigen. Fungiert als Kondensatoragent. Zum Beispiel bei aldolischen Reaktionen, Aminierungsreaktionen und Zyklusadditionsreaktionen. In einigen dieser wirken als radikaler Initiator.
Es ist eine Lewis-Säure und katalysiert Diels-Alder-Reaktionen. Es wird auch als Katalysator in Friedel-Crafts-Reaktionen, zur Herstellung von Farbstoffen und Farbstoffen sowie in der Herstellung von Polyesterpolitischen Harzen verwendet.
Unten ist eine Reaktion, bei der diese Verbindung interveniert:
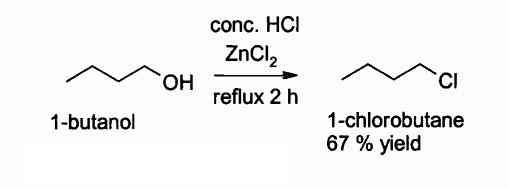 Reaktion des Erhaltens eines Alkylchlorids unter Verwendung von ZNCL2. Autor: Walkerma. Quelle: Wikimedia Commons.
Reaktion des Erhaltens eines Alkylchlorids unter Verwendung von ZNCL2. Autor: Walkerma. Quelle: Wikimedia Commons. In landwirtschaftlichen Aktivitäten
Es wurde als Herbizid in Ernte, als Blattbehandlung verwendet, um Schädlinge wie Pilze und Moos sowie als Mikronährstoff zu beseitigen. Es ist ein Vermittler, Pestizide vorzubereiten.
In Zahnanwendungen
Es wird in Mundwäschen verwendet, die empfohlene Kontaktzeit ist jedoch sehr kurz, sodass sie nur als Adstringent in der Mundschleimhaut fungiert. Es dient als Desensibilisator, wird in dentifischen Pasten verwendet und ist Teil von Zahnzementen.
Kann Ihnen dienen: Natriumchlorit (NACLO2): Struktur, Eigenschaften, Verwendungen, RisikenIn der Textil- und Papierindustrie
Es ist ein Bestandteil des Lösungsmittels, das bei der Herstellung von Rayon oder künstlicher Seide aus Cellulose verwendet wird. Es handelt. Es dient auch dazu, sie zu behandeln und ihre Erhaltung zu bevorzugen.
Es ermöglicht es, Stoffe zu locken, Seide- und Wollfasern zu trennen und als unter Druck und Färbung von Textilien einzuwirken.
Es wird bei der Herstellung von Papierrollen und zur Herstellung von Krepppapier verwendet.
Bei der Herstellung von Nanopartikeln
Durch Reaktion von Zinkchlorid mit Natriumsulfid (Na2S) durch eine sonochemische Methode und in Gegenwart bestimmter organischer Verbindungen werden Nanopartikel von Zinksulfid (Zns) erhalten. Sonochemische Methoden verwenden Schallwellen, um chemische Reaktionen zu verursachen.
Diese Art von Nanomaterialien könnte als photokatalytische Wirkstoffe angewendet werden, um beispielsweise die Aufteilung des Wassers in seinen Komponenten (Wasserstoff und Sauerstoff) durch die Wirkung von Licht zu erzeugen.
In mehreren Anwendungen
- Deodorant, Antiseptikum und Desinfektionsmittel von Gebieten. Moos, Schimmel- und Pilzkontrolle in äußeren benachbarten Strukturen und Bereichen wie Gehwegen, Innenhöfen und Zäunen. Desinfektionsmittel von Toiletten, Harnläden, Teppichen und Druckholz.
- Verwendet in Gemischen für Embalmar und Lösungen für die Erhaltung anatomischer Proben.
- Holzflammenträger.
- Primärzutat in Rauchpumpen, die verwendet werden, um eine Vielzahl von Menschen zu zerstreuen; Feuerwehrleute verwenden sie in Brandbekämpfungsübungen und -praktiken.
 Cinc -Chlorid wird in Rauchpumpen verwendet, die in militärischen Übungen verwendet werden. ODER.S. Verteidigungsministerium aktuelle Photoscpl. Abraham Lopez / 2. Marine Division / Public Domain. Quelle: Wikimedia Commons.
Cinc -Chlorid wird in Rauchpumpen verwendet, die in militärischen Übungen verwendet werden. ODER.S. Verteidigungsministerium aktuelle Photoscpl. Abraham Lopez / 2. Marine Division / Public Domain. Quelle: Wikimedia Commons. - Schweißflusskomponente. In der Metallaufnahme. Für Stahlfarbe, verzinkte und eiserne Badezimmerkomponente mit Kupfer.
- In Magnesium- und Metallzementzementen.
- Emulsionen in der Ölraffinierung zu brechen. Agent in der Asphaltherstellung.
- Elektrolyt in getrockneten Batterien.
 Trockener ZnCL -Akku2. Benutzer: 32bitmaschine; Herausgegeben vom Benutzer Jaybear/CC BY-S (https: // creativeCommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons.
Trockener ZnCL -Akku2. Benutzer: 32bitmaschine; Herausgegeben vom Benutzer Jaybear/CC BY-S (https: // creativeCommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons. - Vulkanisierung von Gummi.
- Dehydriermittel.
Risiken
Es kann Verbrennungen für Augen, Haut und Schleimhäute verursachen.
Wenn er auf seine Zersetzung erhitzt wird, emittiert giftiges Wasserstoffchlorid (HCL) und Zinkoxid (ZnO).
Warnung vor seiner Verwendung als Droge
Obwohl schlüssige Studien fehlen, wird geschätzt, dass schwangere Frauen, wenn diese Verbindung verabreicht wird, den Fötus beschädigen kann. Potenzielle Vorteile könnten jedoch mehr Gewicht als mögliche Risiken haben.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Chloridzink. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Liska, m. et al. (2019). Spezialzement. Zink -Oxychloridzement. In Lees Chemie von Zement und Beton (fünfte Ausgabe). Von Scientedirect erholt.
- Pohanish, r.P. (2017). Chloridzink. In Sittigs Handbuch mit giftigen und gefährlichen Chemikalien und Karzinagenen (siebte Ausgabe). Von Scientedirect erholt.com.
- Gedanken, a. und Perelshtein, ich. (2015). Power -Ultraschall für die Herstellung von Nanomaterialien. In Power Ultraschall. Von Scientedirect erholt.
- Archibald, s.J. (2003). Übergangsmetallgruppen 9-12. Reaktionen und Katalyse. Im Verständnis der Koordinationschemie II. Von Scientedirect erholt.com.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Blei, d.R. (Herausgeber) (2003). CRC -Handbuch für Chemie und Physik. 85th CRC Press.
- « Zinkchromatstruktur, Eigenschaften, erhalten, verwendet, verwendet
- Zinknitratstruktur, Eigenschaften, erhalten, verwendet, verwendet »

