Verteilungspartitionskoeffizient, Verteilung, Anwendungen
- 2174
- 44
- Luca Holdt
Er Trenn- oder Verteilungskoeffizient Es ist definiert als Grund für die Konzentration eines Chemikals oder eines gelösten Stoffes zwischen zwei Mitteln im Gleichgewicht. Dieses Medium kann ein Gas wie Luft sein; eine Flüssigkeit wie Wasser oder Öl; oder eine komplexe Mischung wie Blut oder andere Stoffe.
Der Blut/Luft -Partitionskoeffizient ist wichtig, um den in der Lunge auftretenden Gasaustausch zwischen dem Blut und der Atmosphäre zu erklären.
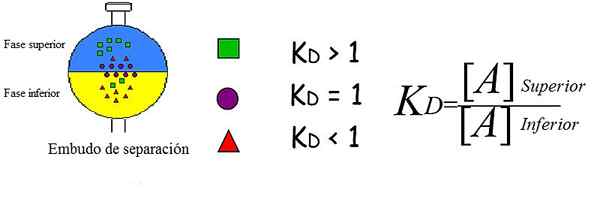
 Diagramm, das den Verteilungskoeffizienten für drei gelöste Stoffe zwischen zwei Phasen erklärt. Quelle: Perdula [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Diagramm, das den Verteilungskoeffizienten für drei gelöste Stoffe zwischen zwei Phasen erklärt. Quelle: Perdula [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Das überlegene Bild zeigt das Konzept, das auf vereinfachte und brillante Weise erklärt wurde. Jede Figur repräsentiert einen Analyten, der verteilt und/oder verteilt zwischen zwei nicht mischbaren Phasen: einer überlegen und der andere niedriger.
Grüne Quadrate befinden sich überwiegend in der oberen Phase; Während sich rote Dreiecke in der unteren Phase mehr auflösen und sich die lila Kreise in die Grenzfläche platzieren.
Es ist zu sehen, wie k unterschiedlich istD Für jeden Analyten. Ja kD Es ist größer als 1, der Analyte wird mehr in die obere Phase verteilt; Wenn sein Wert in der Nähe von 1 liegt, neigt es dazu, in die Schnittstelle zu platzieren. oder wenn im Gegenteil kD ist weniger als 1, wird hauptsächlich in der unteren Phase sein.
Einer der Partitionskoeffizienten ist das, das zwischen zwei nicht mischbaren Flüssigkeiten im Gleichgewicht besteht; ebenso wie das N-Oktan- und Wassersystem. Dieses System wurde verwendet, um eine wichtige Eigenschaft einer Verbindung herzustellen: ihr hydrophober oder hydrophiler Charakter.
Der Wert des Partitionskoeffizienten (P) oder Verteilungskoeffizienten (K) dient dazu, den hydrophoben Charakter eines Arzneimittels anzuzeigen. Somit kann es verwendet werden, um seinen Prozess der Darmabsorption, Verteilung, Stoffwechsel und Ausscheidung vorherzusagen.
[TOC]
Verteilungskoeffizient
Definition
Der Verteilungskoeffizient (k) eines Substanz, der auch als Partitionskoeffizient (P) bezeichnet wird, ist das Verhältnis, die Konzentrationen einer Substanz in zwei Phasen zu teilen; Konstituiert durch die Mischung von zwei Lösungsmitteln, die für unterschiedliche Dichten und Naturen nicht mischbar sind.
Der Wert des Verteilungskoeffizienten (K) oder der Partition (P) hängt mit dem Unterschied der Substanzlöslichkeit in nicht mischbaren Flüssigkeiten zusammen, die Teil des Gemisches sind.
K o p = [Substanz]1 / [Substanz]2
[Substanz]1 Es ist die Konzentration der Substanz in Flüssigkeit 1. Und [Substanz]2 Es ist die Konzentration derselben Substanz in Flüssigkeit 2.
Deutung
Wenn K oder P einen Wert von 3 3 hat, zeigt dies an, dass die Substanz in Flüssigkeit 1 dreimal konzentriert ist als in Flüssigkeit 2. Gleichzeitig weist er auch darauf hin, dass die Substanz in Flüssigkeit 1 löslicher ist.
Wenn der Wert von k oder p 0,3 beträgt, hat die Substanz eine größere Konzentration in Flüssigkeit 2; und daher ist seine Löslichkeit in Flüssigkeit 2 älter als in Flüssigkeit 1.
Kann Ihnen dienen: homogenes SystemOktanol/Wasserpartitionskoeffizient
In einigen Forschungsbereichen wie organischer Chemie und Apotheker wird das Gemisch von Flüssigkeiten durch Wasser und eine apolare Flüssigkeit wie N-Octhanol oder 1-Octanol gebildet, sodass es normalerweise über den durch POW dargestellten Octanol-Partitionskoeffizienten /Wasser erwähnt wird.
Das N-Octhanol hat eine Dichte von 0,824 g/cm3; Während das Wasser, wie bekannt ist, eine Dichte von 1 g/cm hat3 Ungefähr konstant. Sobald die beiden Flüssigkeiten ausgeglichen wurden, ist der N-Octch.
Eine hydrophobe Substanz hat eine größere Konzentration im N-Octhanol, sobald die nicht mischbaren Flüssigkeiten ausgeglichen sind. Andererseits hat eine hydrophile Substanz eine größere Konzentration im Wasser.
Einschränkungen
Der Partition- oder Verteilungskoeffizient wird auf nichtionisierte Substanzen angewendet. Für den Fall, dass der Partitionskoeffizient in einer ionisierbaren Substanz gemessen wird, muss der pH -Wert oder die Verwendung eines Puffers in der wässrigen Phase angepasst werden.
Bei der Bestimmung des Partitionskoeffizienten sollten keine Spannung oder Tensidsubstanzen verwendet werden.
Der N-Octhanol/Wasser-Partitionskoeffizient wird normalerweise in logarithmischer Form ausgedrückt; Das heißt, als log p oder log von k, aufgrund der Amplitude der Werte von p und k.
Wenn das P -log für eine Substanz größer als 0 ist, ist dies anzeigt, dass die Substanz hydrophob ist. Im Gegenteil.
Verteilungskoeffizient (D)
Der Verteilungskoeffizient (d) ist der Quotient zwischen der Konzentration aller ionisierten und nicht ionisierten Substanzen in Flüssigkeit 1 (n-ortanol) und der Konzentration derselben Substanzen in Flüssigkeit 2 (Wasser).
Sobald der Wert des Verteilungskoeffizienten (d) erhalten wurde, kann dies aufgrund der Amplitude der D -Werte als d -logarithmus ausgedrückt werden.
Um den Verteilungskoeffizienten (d) zu erhalten, muss die wässrige Phase gepuffert werden; Das heißt, zu einem bestimmten pH -Wert, der angegeben werden muss, wenn die erhalten.
Kann Ihnen dienen: Benzol: Geschichte, Struktur, Eigenschaften, Derivate, verwendetEs ist bequem, D bei pH 7,4 zu bestimmen. Dieser pH entspricht der des Blutes und repräsentiert die Bedingungen.
Für eine nicht -ionisierbare Verbindung das log D = log P, unabhängig vom verwendeten pH -Wert.
Experimentelle Bestimmung eines Partitionskoeffizienten
Es gibt verschiedene Methoden zur Messung des Partitionskoeffizienten (P). Darunter befinden sich die Methode der Agitation Flaschen und die hohe Flüssigchromatographie mit hoher Auflösung. Sowohl in einem früheren Wissen über die Löslichkeit der Problemsubstanz ist sowohl im N-Octhanol als auch im Wasser erforderlich.
Rührflaschenmethode
Die Probe wird in mit Wasser gesättigter N-Ectchtanol gelöst, das in einem Trichter durchgeführt wird, wird getrennt oder mit gesättigtem Wasser mit N-Octhanol dekantiert. Die Sättigung von Lösungsmitteln ist erforderlich, um die Übertragung von Lösungsmitteln während des Partitionsprozesses zu vermeiden.
Der Dekantationstrichter wird für eine bestimmte Zeit mechanischer Aufregung unterzogen. Dann bleibt es lange in Ruhe, um eine vollständige Trennung sicherzustellen. Abschließend werden die Phasen durch Dekantation getrennt.
Dann wird die Konzentration der Probe in jedem der Lösungsmittel unter Verwendung einer spektrophotometrischen Methode bestimmt; Zum Beispiel UV-sichtbar oder eine andere Methode. Schließlich werden mit den erhaltenen Daten der Partitionskoeffizient und das Protokoll P berechnet.
Diese Methode hat den Vorteil, wirtschaftlich, reproduzierbar und hochpräzision zu sein. Kurz gesagt, es ist die zuverlässigste Methode bei der Bestimmung des Protokolls P.
Der Hauptnachteil der Methode besteht darin, dass sie viel Zeit verbraucht: mehr als 24 Stunden, um Flüssigkeiten, Aufregung und Trennung der Phasen während des Trennprozesses auszugleichen. Darüber hinaus gilt es nur für lösliche Substanzen in N-Octhanol und Wasser.
Hochauflösende Flüssigchromatographie -Methode
Das Protokoll P unter Verwendung der Korrelation der Retentionszeit der Probe kann erhalten werden, wobei die Retentionszeit einer ähnlichen Referenzverbindung für chemische Struktur mit einem bekannten P -Wert ist.
Es ist eine Methode, bei der der Wert von log P in einer Dauer von weniger als 20 Minuten erhalten wird. Gibt logarithmische Werte zwischen 0 und 6 an, was nur hydrophobe Substanzen entspricht.
Der Nachteil ist, dass der Wert von P durch lineare Regression bestimmt wird, so.
Kann Ihnen dienen: Brom: Geschichte, Struktur, elektronische Konfiguration, Eigenschaften, verwendetAnwendungen
Optimierung der Arzneimittelwirkung
Wenn ein Medikament aufgenommen wird, muss es das Licht des Dünndarms erreichen, wo die meisten Substanzen absorbiert werden. Dann kreuzt es das Innere der Zellen und löst sich in der Lipiddoppelschicht auf, die Teil der Membran ist. Dieser Prozess wird durch den hydrophoben Charakter des Arzneimittels bevorzugt.
Das Medikament muss durch die Darmzellen gehen und die Basalmembran überqueren, um das Blut zu erreichen und die Zielrezeptoren der Arzneimittelwirkung zu erreichen. Einige Stadien des globalen Prozesses werden vom hydrophoben Charakter des Arzneimittels bevorzugt, andere nicht.
Ein Wert des Partitionskoeffizienten muss gefunden werden.
Die Verwendung von übermäßig hydrophoben Arzneimitteln kann toxisch sein, da sein Stoffwechsel potenziell schädliche Metaboliten erzeugen kann. Andererseits haben völlig hydrophile Medikamente Schwierigkeiten in ihrer Darmabsorption.
Agrochemische Produkte
Die Aktivität von Insektiziden und Herbiziden wird durch ihren hydrophoben Charakter beeinflusst. Hydrophobizität ist jedoch mit einem längeren halben Leben verbunden. Daher ist der Schadstoffeffekt auf die Umwelt verlängert und kann ökologische Schäden verursachen.
Hydrophobe Produkte, die effizient wirken, mit einem kürzeren halben Leben auftreten muss.
Umweltschutz
Hydrophobe Verbindungen sind in der Regel Schadstoffe für die Umwelt, da sie durch den Boden entwässert werden und anschließend Flusswasser erreichen können.
Wenn Sie den Partitionskoeffizienten einer Verbindung kennen, können Veränderungen in ihrer chemischen Struktur vorgenommen werden, die die Hydrophobizität verändern, um die Umweltverschmutzung zu verringern.
Hydrogeologie verwendet den Octanol/Wasser -Gusskoeffizienten (KOW), um den Fluss hydrophober Verbindungen sowohl am Boden als auch im Grundwasser zu kontrollieren.
Verweise
- Bannan, c. C., Calabró, g., Kyu, d. UND., & Mobley, D. L. (2016). Berechnung der Partitionskoeffizienten von kleinen Molekülen in Octanol/Wasser und Cyclohexan/Wasser. Zeitschrift für chemische Theorie und Berechnung, 12(8), 4015-4024. Doi: 10.1021/ACS.JCTC.6B00449
- Wikipedia. (2019). Verteilungskoeffizient. Geborgen von: ist.Wikipedia.Org
- Nationale Universität Kolumbien. (S.F.). Einheit 8: Experimentelle Bestimmung des Verteilungskoeffizienten von Barbituraten. [PDF]. Wiederhergestellt aus: Netzwerk.ein i.Edu.CO
- Der Sevier. (2019). Verteilungskoeffizient . Wissenschaft direkt. Abgerufen von: Scientedirect.com
- Seeboo Hemnath. (2019). Partitionskoeffizient: Definition und Berechnung. Lernen. Erholt von: Studium.com
- « Hintergrund, Ursachen, Merkmale englischer landwirtschaftlicher Revolution
- Hämokultur Wofür es, Fundament, Verfahren, Ergebnisse »

