Binärverbindungen Bildung, Typen, Beispiele, Nomenklatur
- 4187
- 331
- Tizian Liebich
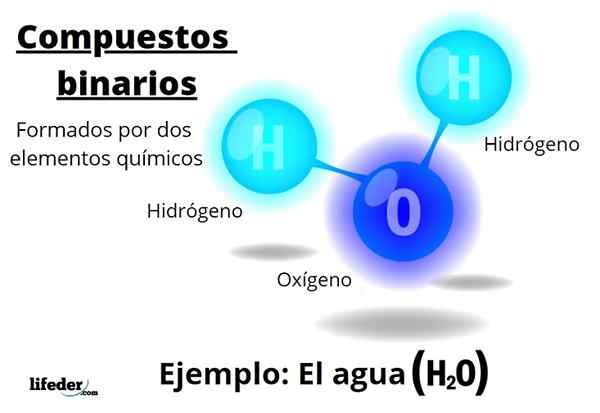
Der Binäre Verbindungen Sie werden alle durch zwei chemische Elemente gebildet, unabhängig von der Anzahl ihrer Atome oder ihrer Wechselwirkungen. Die allgemeine Formel für diese Verbindungen istNBM, wobei A und B zwei verschiedene Elemente des Periodenzüchtertabels sind und N Und M ihre jeweiligen stöchiometrischen Koeffizienten.
Zum Beispiel Wasser, h2Oder es ist eine binäre Verbindung, die vielleicht der repräsentativste für sie ist. Wasser besteht aus Wasserstoff, H und Sauerstoff oder fügt so zwei chemische Elemente hinzu. Beachten Sie, dass seine stöchiometrischen Koeffizienten darauf hinweisen, dass es zwei Wasserstoff und einen Sauerstoffatome gibt, aber immer noch eine binäre Verbindung ist.

Binäre Verbindungen können aus Ionen, Molekülen, dreidimensionalen Netzwerken oder sogar neutralen Metallatomen bestehen. Das Wichtigste ist, dass unabhängig von der Art seiner chemischen Bindung oder ihrer Zusammensetzung immer zwei verschiedene chemische Elemente gebildet wird. Zum Beispiel Wasserstoffgas, H2, zählt nicht als binäre Verbindung.
Binäre Verbindungen scheinen anfangs nicht so reichlich und komplex im Vergleich zu ternären oder quaternären Verbindungen zu sein. Unter ihnen sind jedoch viele wesentliche Substanzen für terrestrische Ökosysteme wie Salze, Oxide, Sulfide und einige Gase mit immensem biologischem und industriellem Wert zu sehen.
[TOC]
Wie sind binäre Verbindungen?
Präparationsmethoden oder synthetische Wege zur Bildung binärer Verbindungen hängen von den Identitäten der beiden chemischen Elemente A und B ab. Grundsätzlich und im Allgemeinen müssen beide Elemente in einem Reaktor kombiniert werden, damit sie miteinander interagieren können. Wenn die Bedingungen günstig sind, findet eine chemische Reaktion statt.
Mit einer chemischen Reaktion werden die Elemente A und B (ionisch oder kovalent) verbinden oder die Verbindung zu bildenNBM. Viele binäre Verbindungen können durch die direkte Kombination ihrer beiden reinen Elemente oder durch die direkte wirtschaftlich lebensfähigere alternative Methoden gebildet werden.
Es kann Ihnen dienen: Zinkoxid (ZnO): Struktur, Eigenschaften, Verwendung, RisikenRückkehr zum Beispiel von Wasser, Wasserstoff, H2, und Sauerstoff oder2, Sie kombinieren bei hohen Temperaturen, so dass zwischen ihnen eine Verbrennungsreaktion besteht:
2H2(g) + oder2(g) → 2H2O (g)
Wasser dagegen kann durch Dehydratisierungsreaktionen von Verbindungen wie Alkohol und Zucker erhalten werden.
Ein weiteres Beispiel für die Bildung einer binären Verbindung entspricht dem Eisensulfid, fes:
Glauben (s) + s (s) → fes (s)
Wo diesmal sowohl Eisen als auch Schwefel fest sind und keine Soda -Substanzen. Und dies gilt mit mehreren Binärsalzen, zum Beispiel Natriumchlorid, NaCl, das metallisches Natrium mit Chlorgasen kombiniert:
2na (s) + cl2(g) → 2nacl (s)
Nomenklatur
Die Namen aller binären Verbindungen werden hauptsächlich den gleichen Regeln bestimmt.
Für die Verbindung zuNBM, Der Name B wird zuerst in seiner anionischen Form erwähnt; Das heißt, mit dem Ende -uro. In dem Fall, dass B jedoch aus Sauerstoff besteht, wird es als Oxid, Peroxid oder Superoxid bezeichnet.
Dem Namen von B geht es den griechischen Zahlenpräfixen voraus (Mono, Di, Tri, Tetra usw.) nach dem Wert von M.
Schließlich wird der Name von Element A erwähnt. Für den Fall, dass es mehr als eine Valenz hat, wird es mit römischen Zahlen und in Klammern angezeigt. Oder wenn bevorzugt, können Sie die traditionelle Nomenklatur auswählen und die Suffixe -ooso e -ICO verwenden. Element A geht manchmal auch den griechischen Zahlenpräfixen nach dem Wert von voraus N.
Betrachten Sie die folgenden binären Verbindungen zusammen mit ihren jeweiligen Namen:
-H2O: Wasserstoffoxid oder Dihydrogenmonoxid (dieser Nachname ist eine Ursache für das Nacken)
-FES: Eisensulfid (II) oder Eisensulfid
-NaCl: Natriumchlorid oder Natriumchlorid
Kann Ihnen dienen: Öl oder Benzinether: Formel, Struktur, verwendet-Mgcl2: Magnesiumchlorid, Magnetchlorid oder Magnesium -Dichlorid
Beachten Sie, dass nicht "Monosodiumchlorid" oder "Monohierro -Sulfid" gesagt wird.
Typen: Klassifizierung von binären Verbindungen
Binärverbindungen werden nach den gebildeten oder Fakten klassifiziert: Ionen, Moleküle, Metallatome oder Netzwerke. Trotzdem ist diese Klassifizierung nicht völlig schlüssig oder endgültig, was je nach berücksichtigter Ansatz variieren kann.
Ionisch
In ionischen binären Verbindungen bestehen A und B aus Ionen. Damit die Verbindung zu der Verbindung zuNBM, B ist normalerweise ein Anion, b-, Während ein Kation zu+. Zum Beispiel gehört NaCl zu dieser Klassifizierung sowie allen binären Salzen, deren allgemeine Formeln besser als MX dargestellt werden, wobei x ein Anion ist, und M ein metallisches Kation.
So Fluoride, Chloride, Bromuros, Jodid., Sie gehören auch zu dieser Klassifizierung. Es ist jedoch zu beachten, dass einige von ihnen kovalent sind und daher zur folgenden Klassifizierung gehört.
Kovalent
Kovalente binäre Verbindungen werden durch Moleküle gebildet. Das Wasser gehört zu dieser Klassifizierung, da es aus H-O-H-Molekülen besteht. Wasserstoffchlorid, HCl, wird auch als kovalente binäre Verbindung angesehen, da es aus H-Cl-Molekülen besteht. Beachten Sie, dass der NaCl ionisch ist, während die HCl kovalent ist und beide Chloride sind.
Metallische oder Netzwerke
Binäre Verbindungen bedecken auch die Legierungen und Festkörper von drei dimensionalen Netzwerken. Für sie wird jedoch die Konfession von binären Materialien normalerweise besser verwendet.
Zum Beispiel wird Messing, mehr als eine Verbindung, als binäres Material oder eine Legierung angesehen, da es durch Kupfer und Zink Cu-Zn gebildet wird. Beachten Sie, dass es nicht geschrieben wurde, indem sie stöchiometrische Koeffizienten nicht definiert haben.
Ebenso gibt es Siliziumdioxid, Sio2, gebildet durch Silizium und Sauerstoff. Ihre Atome werden durch Definieren eines dreidimensionalen Netzwerks verbunden, in dem Sie nicht über Moleküle oder Ionen sprechen können. In vielen Nitriden, Phosphon und Carbiden, handelt es sich auch um diese Art von Netzwerken, wenn sie nicht ionisch sind.
Kann Ihnen dienen: Phänoxyessigsäure: Synthese, Verfahren, Verwendungen, RisikenBeispiele für binäre Verbindungen
 Wasser ist ein Beispiel für eine binäre Verbindung
Wasser ist ein Beispiel für eine binäre Verbindung Es wird aufgeführt, um mehrere binäre Verbindungen zu beenden, die von ihren jeweiligen Namen begleitet werden:
-Libr: Lithiumbromid
-CaCl2: Calciumchlorid
-Fecl3: Eisenchlorid (III) oder Eisenchlorid
-Nao: Natriumoxid
-Verhalten2: Beryllium Hydrid
-CO2: Kohlendioxid
-NH3: Stickstoff- oder Ammoniak -Trihydrid
-BIP2: Blei Iodid (ii) oder Bleidiyoduro
-Mg3N2: Magnesium nitruro
-Zum2ENTWEDER3: Aluminiumoxid oder Diaminiumtrioxid
-N / A3F: Natriumphosphuro
-Alf3: Aluminiumfluorid
-Racl2: Radiochlorid oder Radio -Dichlorid
-Bf3: Boro Trifluoruro
-RBI: Rubidio Yoduro
-WC: Wolframkarbid oder Wolframium
Jedes dieser Beispiele kann mehr als einen Namen gleichzeitig haben. Von diesen die co2 Es hat einen großen Einfluss auf die Natur, da es von Pflanzen im Prozess der Photosynthese verwendet wird.
Andererseits der NH3 Es ist eine der Substanzen mit dem industriellsten Wert, der für die Synthese der polymeren und organischen Synthese erforderlich ist. Und schließlich ist das WC eines der härtesten Materialien, die jemals geschaffen wurden.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Artem Cheprasov. (2020). Was ist eine binäre Verbindung? - Definition & Beispiel. Lernen. Erholt von: Studium.com
- Helmestine, Anne Marie, ph.D. (11. Februar 2020). Definition der binären Verbindung. Erholt von: thoughtco.com
- Byju. (2020). Was sind binäre Verbindungen? Erholt von: Byjus.com
- Chemteam. (S.F.). Binäre Verbindungen von Metallen mit festen Ladungen. Erholt von: Chemteam.Die Info
- Wikipedia. (2020). Binärphase. Abgerufen von: in.Wikipedia.Org
- « Nitriteneigenschaften, Struktur, Nomenklatur, Schulung
- Reaktionsflockung, Typen, Anwendungen, Beispiele »

