Merkmale, Schulungen, Beispiele
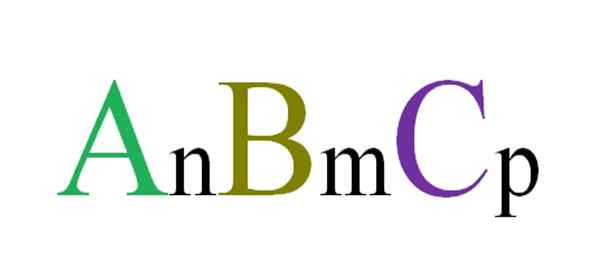
- 1543
- 197
- Ibrahim Steuk
Der Ternäre Verbindungen Sie sind alle, die aus drei verschiedenen Atomen oder Ionen bestehen. Sie können sehr unterschiedlich sein, von Säure- oder Basissubstanzen über Metalllegierungen, Mineralien oder moderne Materialien. Die drei Atom.
Damit die ternäre Verbindung auftritt, muss es jedoch eine chemische Affinität zwischen ihren Atomen geben. Nicht alle sind miteinander kompatibel, und daher können Sie nicht einfach zufällig wählen, welche drei die Verbindung oder das Gemisch integrieren und definieren (unter der Annahme des Mangels an kovalenten Bindungen).
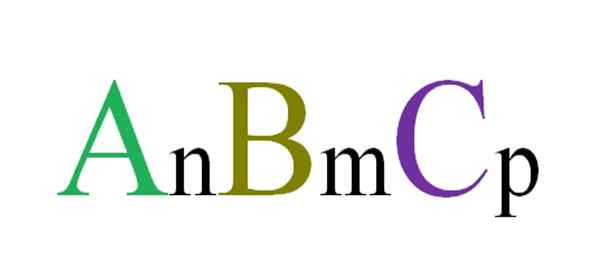 Allgemeine und zufällige Formel für ternäre Verbindungen. Quelle: Gabriel Bolívar.
Allgemeine und zufällige Formel für ternäre Verbindungen. Quelle: Gabriel Bolívar. Zum Beispiel werden drei Buchstaben zufällig ausgewählt, die eine ABC -Ternäre Verbindung (überlegenes Bild) regeln. Indexs n, m und p geben stöchiometrische Beziehungen zwischen Atomen oder Ionen A, B und C an. Variieren Sie die Werte solcher Indexs und die Identität der Buchstaben, endlose ternäre Verbindungen werden erhalten.
Formel A jedoch jedochNBMCP Es wird nur dann gültig sein, wenn es Elektroneuterität erfüllt. Das heißt, die Summe Ihrer Gebühren muss gleich Null sein. In diesem Sinne gibt es physikalische (und chemische) Einschränkungen, die steuern, ob die Bildung der ternären Verbindung möglich ist oder nicht.
[TOC]
Eigenschaften von ternären Verbindungen
Seine Eigenschaften sind nicht allgemein, sondern variieren je nach chemischer Natur von ihnen. Zum Beispiel sind Oxoähren und Basen ternäre Verbindungen, und jedes von ihnen teilt oder nicht eine Reihe repräsentativer Merkmale.
Nun, bevor eine hypothetische Verbindung ABC ist, kann dies ionisch sein, wenn die Unterschiede der Elektronegativität zwischen A, B und C nicht groß sind; oder kovalent, mit Links a-b-c. Letztere werden in unendlichen Beispielen innerhalb der organischen Chemie angegeben, wie bei Alkoholen, Phenolen, Ether, Kohlenhydraten usw., deren Formeln mit c beschrieben werden könnenNHM ENTWEDERP.
Kann Ihnen dienen: mechanische Eigenschaften von MetallenSomit sind die Eigenschaften sehr unterschiedlich und schwingen in dem hohen Grad einer ternären Verbindung zu einer anderen oszillieren. Die Verbindung cNHMENTWEDERP Es wird gesagt, dass es sauerstoffhaltig ist; während cNHMNP, Andererseits ist es Stickstoff (es ist ein Amin). Andere Verbindungen können Schwefel, phosphor, fluorisiert sein oder einen deutlichen metallischen Charakter haben.
Basen und Säuren
Auf dem Gebiet der anorganischen Chemie haben Sie Metallbasen, mNENTWEDERMHP. Geben.
Zum Beispiel sollte die NaOH -Basis unter Berücksichtigung solcher Indexte als NA geschrieben werden1ENTWEDER1H1 (was chaotisch wäre). Darüber hinaus würde angenommen, dass H als Kation H ist+, Und nicht wie es wirklich erscheint: Teil von Anion OH zu sein-. Aufgrund der Aktion von OH- Auf der Haut sind diese Basen Seifen und ätzend.
Die Metallbasen sind ionische Substanzen, und obwohl sie aus zwei Ionen bestehen, mN+ und oh- (N / A+ und oh- Für die NaOH) sind sie ternäre Verbindungen für drei verschiedene Atome.
Säuren hingegen sind kovalent und ihre allgemeine Formel ist Hao, wo ein nicht -metallisches Atom normalerweise ist. Angesicht+ Corroen und verletze die Haut.
Nomenklatur
Wie die Eigenschaften ist die Nomenklatur der ternären Verbindungen sehr unterschiedlich. Aus diesem Grund werden nur nur die Basen, Oxoäakien und Oxisals oberflächlich betrachtet.
Basen
Metallbasen werden zuerst mit dem Wort "Hydroxid" erwähnt, gefolgt vom Namen des Metalls und seiner Wertigkeit in römischen Zahlen in Klammern. Somit ist NaOH Natriumhydroxid (i); Da das Natrium jedoch eine einzigartige Valenz von +1 hat, bleibt es einfach als Natriumhydroxid.
Es kann Ihnen dienen: AlceansDer Al (OH)3, Zum Beispiel ist es Aluminiumhydroxid (III); und cu (oh)2, Kupferhydroxid (II). Natürlich alle nach der systematischen Nomenklatur.
Oxoaziden
Oxóacids haben eine ziemlich allgemeine Formel des Hao -Typs; Aber in Wirklichkeit werden sie besser als AOH beschrieben. Ha-hs Link entsteht, dass die H veröffentlicht wird+.
Die traditionelle Nomenklatur lautet wie folgt: Das Wort 'Säure' beginnt, gefolgt vom Namen des zentralen Atom oder ältere Valenzen.
Zum Beispiel sind Bromoxoäakids Hbro, Hbro2, Hbro3 und Hbro4. Dies sind Säuren: hypobrom, brom, brom und perbromisch. Beachten Sie, dass es in allen drei Atomen mit unterschiedlichen Werten für ihre Indexs gibt.
Oxisals
Auch als Nullion -Salze bezeichnet, sind sie die repräsentativsten für ternäre Verbindungen. Der einzige Unterschied, um sie zu erwähnen. Auch H wird durch ein Metallkation ersetzt, Produkt der Säure-Base-Neutralisation.
Seine Natriumoxisals wären mit Brom weiter: Nabro, Nabro2, Nabro3 und Nabro4. Ihre Namen würden werden: Hipobromito, Bromito, Bromato und Natriumperbromat. Ohne Zweifel übersteigt die Anzahl der möglichen Oxisals die von Oxoaziden.
Ausbildung
Auch hier hat jede Art von ternärer Verbindung ihren eigenen Ursprung oder Schulungsprozess. Es ist jedoch fair zu erwähnen, dass diese nur dann gebildet werden können, wenn zwischen den drei Atommitgliedern eine ausreichende Affinität besteht. Zum Beispiel existieren Metallbasen dank elektrostatischer Wechselwirkungen zwischen Kationen und OH-.
Kann Ihnen dienen: ZitronensäureÄhnliches passiert bei Säuren, die nicht gebildet werden konnten, wenn keine solche kovalente Bindung a-o-h gab.
Basierend auf der Frage, wie sich die Hauptverbindungen bilden? Die direkte Antwort lautet wie folgt:
- Metallbasen werden durch Auflösen von Metalloxiden in Wasser oder in einer alkalischen Lösung (normalerweise durch NaOH oder Ammoniak) gebildet (normalerweise von NaOH oder Ammoniak).
- Oxoäakien sind das Produkt der Auflösung von nicht -metallischen Oxiden in Wasser; Unter ihnen die co2, Clo2, NEIN2, SW3, P4ENTWEDER10, usw.
- Und dann entstehen Oxisals, wenn Oxoäakien mit einer Metallbasis alkalisiert oder neutralisiert werden; Daraus kommen die Metallkationen, die H ergänzen H+.
Andere ternäre Verbindungen werden nach einem komplizierteren Prozess gebildet, wie bei bestimmten Legierungen oder Mineralien.
Beispiele
Schließlich wird eine Reihe von Formeln für verschiedene ternäre Verbindungen als Liste angezeigt:
- Mg (OH)2
- Cr (OH)3
- Kmno4
- N / A3Bo3
- CD (OH)2
- Älterer Bruder3
- Feaso4
- BACR2ENTWEDER7
- H2SW4
- H2Teo4
- Hcn
- Vor
Andere weniger häufige (und sogar hypothetische) Beispiele sind:
- Cofecu
- Algasn
- UCAPB
- Bemgo2
Die Indexs n, m und p wurden weggelassen, um die Formeln nicht zu komplizieren; Obwohl in Wirklichkeit seine stöchiometrischen Koeffizienten (mit Ausnahme des Besten für das Bemgo2), kann sogar Dezimalwerte haben.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- FRAU. Hilfstein. (S.F.). Ternäre Komuns. Erholt von: Tenafly.K12.NJ.uns
- Wikipedia. (2019). Ternärer Komund. Abgerufen von: in.Wikipedia.Org
- Carmen Bello, Arantxa Isasi, Ana Puerto, Germán Tomás und Ruth Vicente. (S.F.). Ternäre Verbindungen. Erholt von: IESDMJAC.Bildung.Aragon.Ist
- « Quartärverbindungen Eigenschaften, Training, Beispiele
- Spezielle Verbindungsmerkmale, Training, verwendet »

