Prozentuale Konzentration

- 4528
- 1298
- Ibrahim Steuk
Was ist die prozentuale Konzentration??
Der prozentuale Konzentration Es ist eine Möglichkeit, die Beziehung des gelösten Stoffes in einhundert Teilen des Mischens oder der Lösung auszudrücken. Es ist zu beachten, dass diese "Teile" in Massen- oder Volumeneinheiten ausgedrückt werden können. Dank dieser Konzentration ist die Zusammensetzung einer Lösung bekannt, die im Gegensatz zu einer reinen Verbindung nicht konstant ist.
Nicht nur seine Zusammensetzung variiert, sondern auch seine organoleptischen Eigenschaften. Das untere Bild -Teeglas erhält intensivere Aromen (und Farbfärben), da mehr Gewürze in Eiswasser gelöst werden. Obwohl sich ihre Eigenschaften ändern, bleibt die Konzentration dieser Gewürze konstant.

Wenn wir davon ausgehen, dass 100 Gramm davon in Wasser gelöst und dann genug gerührt werden, um die Lösung zu homogenisieren, werden die Gramme im gesamten Glas verteilt. Die prozentuale Konzentration von Tee bleibt konstant, selbst wenn der Flüssigkeitsgehalt in verschiedene Behälter unterteilt ist.
Dies variiert nur dann, wenn dem Glas mehr Wasser hinzugefügt wird, was zwar die ursprüngliche Masse von gelösten Gewürzen (gelöster) nicht modifiziert, ihre Konzentration ändert. Für das Beispiel der Teequote kann diese Konzentration in der Masse des gelösten Stoffes zwischen Wasservolumen bequem ausgedrückt werden.
Somit spielen die unendlichen Fälle, in denen diese Konzentrationsberechnungen eine entscheidende Rolle spielen.
Was ist eine Lösung?
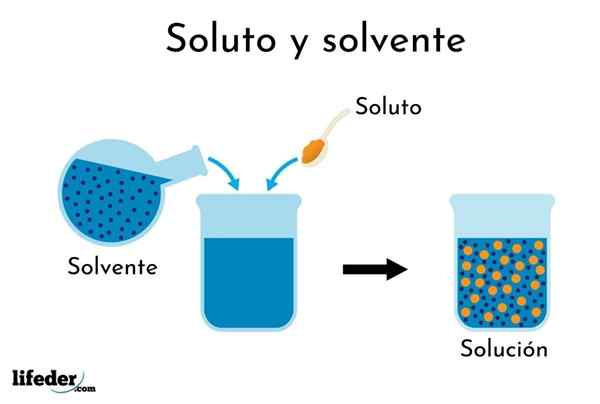 Der gelöste gelöste löst sich im Lösungsmittel auf
Der gelöste gelöste löst sich im Lösungsmittel auf Das Verständnis des Begriffs „Lösung“ ist erforderlich, bevor die prozentualen Ausdrücke seiner Konzentration angesprochen werden.
Eine Lösung ist eine homogene oder gleichmäßige Mischung aus zwei oder mehr Substanzen, deren Partikel atomare oder molekulare Größe haben.
Es kann Ihnen dienen: Was sind die negativen Auswirkungen, die wir auf die Wasserlöslichkeit haben?Die Komponenten davon sind der gelöste und das Lösungsmittel. Der gelöste gelöste ist das in einer Lösung gelöste Material, das in geringerem Verhältnis ist. Das Lösungsmittel ist das Dispersionsmittel in einer Lösung und ist in größerem Verhältnis (wie Wasser im Teeglas).
Eigenschaften der prozentualen Konzentration
- Die prozentuale Konzentration zeigt den Komfort, Molaritätsberechnungen und andere Konzentrationseinheiten zu vermeiden. In vielen Fällen reicht es aus, die Menge des in der Lösung aufgelösten Stoffmenge zu kennen. Bei chemischen Reaktionen verlässt es jedoch eine Seite durch Molonkonzentration.
- Erleichtert die Überprüfung des Massenschutzgesetzes.
- Es wird in Teilen pro hundert Lösung ausgedrückt, innerhalb derer der gelöste Stoff gezählt wird.
- Die Beziehung zwischen dem gelösten Stoff und der Lösung kann in Masseneinheiten (Gramm) oder Volumen (Milliliter) ausgedrückt werden.
Wie wird es berechnet?
Der Weg zur Berechnung dessen hängt von den Einheiten ab, in denen Sie es ausdrücken möchten. Die mathematische Berechnung ist jedoch im Wesentlichen gleich.
Sowohl prozentual Gewicht nach Gewicht % m/m
% (m / m) = (Gramm Stoff / Gramm Lösung) ∙ 100
Der Prozentsatz einer Lösung zeigt die Anzahl der Stoff -Gramm in jeweils 100 Gramm Lösung an.
Beispielsweise enthält eine 10 % m/m -Lösung von NaOH 10 Gramm NaOH pro 100 Gramm Lösung. Es kann auch auf diese Weise interpretiert werden: 10 g NaOH werden in 90 g Wasser gelöst (100-10).
Sowohl das Gewicht des Prozentsatzes in Volumen % m/v
% (m / v) = (Gramm Stoff / Milliliter der Lösung) ∙ 100
Kann Ihnen dienen: quaternäre Verbindungen: Merkmale, Schulungen, BeispieleDer Prozentsatz in Milligramm ist eine Konzentrationseinheit, die häufig in klinischen Berichten verwendet wird, um extrem niedrige Konzentrationen des gelösten Stoffes zu beschreiben (z. B. Mineralspuren im Blut).
Als spezifischer Fall gibt es das folgende Beispiel: Der Stickstoffniveau im Blut einer Person beträgt 32 mg%, was bedeutet, dass es 32 mg gelöstes Stickstoff pro 100 ml Blut gibt.
Sowohl das Prozentvolumen in Volumen % v/v
% (v / v) = (Milliliter von gelösten Lösung / Millilitern) ∙ 100
Das prozentuale Volumenvolumen einer Lösung zeigt die Anzahl der Milliliter von gelösten Stoffnähern in jeweils 100 Millilitern Lösung an.
Zum Beispiel enthält eine 25%V/V -Lösung von Alkohol in Wasser 25 Milliliter Alkohol pro 100 Milliliter Lösung oder was ist das Gleiche: 75 ml Wasser löst 25 ml Alkohol auf.
Beispiele für prozentuale Konzentrationsberechnungen
Beispiel 1
Wenn sie 7 g Kio haben3, Wie viele Gramm von 0,5 % m/m -Lösung können mit dieser Salzmenge vorbereitet werden?
Eine 0,5 % m/m -Lösung ist sehr verdünnt und wird wie folgt interpretiert: Für alle 100 Gramm Lösung gibt es 0,5 Gramm Kio3 aufgelöst. Um die Gramm dieser Lösung zu bestimmen, die vorbereitet werden können, werden Konversionsfaktoren verwendet:
7 g Kio3 ∙ (100 g Sonne/ 0.5 g Kio3) = 1400 g oder 1.4 kg Lösung.
Wie ist es möglich? Offensichtlich kam die große Menge Masse aus Wasser; So sind die 7 Gramm Kio3 Sie lösten sich in 1393 Gramm Wasser auf.
Kann Ihnen dienen: Batchreaktor: Eigenschaften, Teile, AnwendungenBeispiel 2
Wenn Sie 500 Gramm einer Cuso -Lösung vorbereiten möchten4 1 %, wie viele Gramm Basissalz sind notwendig?
Umwandlungsfaktoren werden angewendet, um das g Cuso zu löschen4 Gewünscht:
500 g Cuso -Sonne4 ∙ 1 g Cuso4/ 100 g Cuso Sonne4) = 5 g Cuso4
Das heißt, 5 g Cuso lösten sich auf4 (Ein helles bläuliches Farben Salz) in 495 g Wasser (ungefähr 495 ml)
Beispiel 3
Wenn 400 ml Wasser gemischt sind, 37 Gramm Zucker, 18 Gramm Salz und 13 Gramm Natriumsulfat (NA)2SW4), Wie hoch ist die Massenprozentsatzkonzentration für jede der Mischkomponenten?
Wenn angenommen wird, dass die Wasserdichte 1 g/ ml beträgt, hat die Mischung 400 g Wasser. Das Hinzufügen der Gesamtmasse der Lösungskomponenten ist: (400 + 37 + 18 + 13) = 468 g Lösung.
Hier ist die Berechnung direkt und einfach:
%Wasser m/ m = (400 g Wasser/ 468 g Sonne) ∙ 100 = 85.47
%Zucker M/ M = (37 g Zucker/ 468 g Sonne) ∙ 100 = 7.90
%Salz m/ m = 18 g Salz/ 468 g Sonne) ∙ 100 = 3.84
%N / A2SW4 m/m = 13 g na2SW4/ 468 g Sonne) ∙ 100 = 2.77
Hinzufügen aller einzelnen Massenprozentsätze sind: (85,47 + 7,90 + 3,84 + 2,77) = 99,98 % ≈ 100 %, die Gesamtmischung.

