Chemische Konzentration

- 4034
- 203
- Medine Kedzierski
 Chemische Konzentration bestimmt den Anteil eines gelösten Stoffes und eines Lösungsmittels in einer chemischen Lösung
Chemische Konzentration bestimmt den Anteil eines gelösten Stoffes und eines Lösungsmittels in einer chemischen Lösung Was ist chemische Konzentration?
Der Chemische Konzentration Es ist eine Eigenschaft der Lösungen, die die Menge an gelösten Stoff für jede Lösungeinheit darstellt. Mit anderen Worten, es ist eine Zahl, die den Anteil angibt, in dem sich der gelöste Stoff und das Lösungsmittel befinden.
Erinnern Sie sich daran, dass eine Lösung eine homogene Mischung ist, die durch ein Lösungsmittel (im Allgemeinen flüssig) und eine oder mehrere Substanzen, die in dem Lösungsmittel gelöst sind. Die Lösungen sind durch das Lösungsmittel, den gelösten Stoff und die Konzentration gekennzeichnet.
Die Konzentration ist eine sehr nützliche Eigenschaftseigenschaft, da wir sie beschreiben können. Wenn wir beispielsweise wissen, dass die Salzkonzentration im Meerwasser für jeden Liter 35 Gramm beträgt, dann wissen wir, dass wir in unserem Haus 35 Gramm Salz in einem Liter der Lösung auflösen, die wir gleichzig lösungslöslich wie Meerwasser erhalten.
Eigenschaften der chemischen Konzentration
Es ist ein intensives Eigentum
Dies ist das Hauptmerkmal der Konzentration. Intensiv bedeutet, dass es nicht von der Menge an Lösung abhängt, die wir haben. Als Beispiel bedeutet dies, dass die Konzentration in einem Wasserwasserabfall gleich ist wie in 100 Litern derselben.
Kann mit der Temperatur variieren
Im Allgemeinen erweitern sich Flüssigkeiten oder erhöhen ihr Volumen beim Erhitzen. Dies gilt auch für Lösungen. Aus diesem Grund können sich die Konzentrationen, die je nach Volumen ausgedrückt werden, beim Erhitzen oder Abkühlen der Lösung geringfügig ändern.
Es kann sehr breite Reichweite abdecken
Unabhängig von den Einheiten, in denen eine chemische Konzentration exprimiert wird, kann sie von relativ großen Werten bis zu extrem kleinen Werten haben.
Zum Beispiel kann die Konzentration einer in Prozent ausgedrückten Lösung Werte von 0% bis 100% haben und so viele Größenordnungen abdecken. Wir konnten eine 90%ige Lösung vorbereiten, da wir auch einen bis 10 vorbereiten konnten-12%, was fast 14 Ordnungen von geringer Größenordnung sind.
Was ist chemische Konzentration für?
Wenn wir die Konzentration einer Lösung kennen, können wir sie beschreiben. Es gibt viele Eigenschaften von Lösungen, die von ihrer Konzentration abhängen. Zum Beispiel hängen der Schmelz- und das Siedepunkt von der Konzentration ab. Daher ermöglicht es uns, diese beiden Eigenschaften zu berechnen.
Kann Ihnen dienen: GlaskörperzustandAndererseits ermöglicht es uns Konzentration, eine Lösung leicht mit einer anderen zu vergleichen. Wenn wir zwei Wasserlösungen mit Zucker haben, können wir wissen, dass ihre Konzentrationen wissen, welcher der beiden süßer ist.
Darüber hinaus hängen alle chemischen Reaktionen, die das Leben ermöglichen.
Zum Beispiel bestimmt die Konzentration von Sauerstoff in der Luft, ob eine Person erstickt oder nicht; Der pH -Wert einer Lösung (eine Möglichkeit, die Konzentration von H -Ionen zu messen+) Bestimmen Sie, ob eine Bakterien leben und sich reproduzieren oder ob sie im Gegenteil sterben wird; und die Konzentration eines Giftes bestimmt, ob es tödlich sein wird oder nicht.
Arten von Konzentrationseinheiten
Die Konzentration einer Lösung ist eins, daher ist es nicht korrekt, über Arten der Konzentration zu sprechen. Die gleiche Konzentration kann jedoch in verschiedenen Arten von Konzentrationseinheiten exprimiert werden. Diese sind:
- Physische Konzentrationseinheiten
- Chemische Konzentrationseinheiten
Physische Konzentrationseinheiten
Diese sind durch Ausdruck der Mengen des gelösten Stoffes und des Lösungsmittels entweder in Massen- oder Volumeneinheiten gekennzeichnet. Sie werden als physische Einheiten bezeichnet, da sie mit Massen und Volumina anstelle von Maulwürfen und Äquivalent verbunden sind.
Wenn wir zwei Lösungen mit der gleichen physikalischen Konzentration vergleichen, können wir nicht sicherstellen, dass sie gleiche Mengen an Atomen und Molekülen haben. Dies unterscheidet sie von chemischen Konzentrationseinheiten.
Die häufigsten physikalischen Konzentrationseinheiten sind:
- Einfacher Titel (TS)
- %Gewicht/Gewicht (%P/P) oder Masse/Masse (%m/m)
- %Gewicht/Volumen (%P/V) oder Masse/Volumen (%m/v)
- % Volumen/Volumen (% v/v)
- Teile pro Million Gewicht/Gewicht (ppmp/p) oder Masse/Masse (ppmm/m)
- Teile pro Million Gewicht/Volumen (ppmp/v) oder Masse/Volumen (ppmm/v)
- Teile pro Million Volumen/Volumen (ppmV/v)
Chemische Konzentrationseinheiten
Bei chemischen Einheiten werden die Menge des gelösten Stoffes und in einigen Fällen das des Lösungsmittels oder der Lösung in Bezug auf die Anzahl der Partikel oder Maulwürfe oder Äquivalente in der Lösung ausgedrückt.
Sie werden als chemische Einheiten bezeichnet, da zwei Lösungen mit der gleichen chemischen Konzentration äquivalente Mengen an Atomen, Molekülen oder gelösten Ionen pro Lösungeinheit aufweisen.
Kann Ihnen dienen: Löslichkeitsregeln: Allgemeine Aspekte und RegelnDie häufigsten chemischen Einheiten sind:
- Molarität (m)
- Molalität (m)
- Molfraktion (x)
- Normalität (n)
Formel der physikalischen Konzentrationseinheiten
Einfacher Titel (TS)
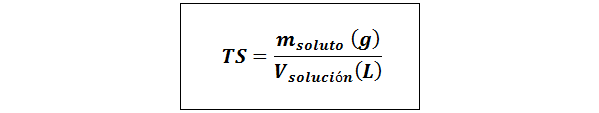
Wo mgelöst repräsentiert die Masse des gelösten Stoffes in Gramm und vLösung Es ist das Volumen der Lösung in Litern.
%Gewicht/Gewicht (%P/P) oder Masse/Masse (%m/m)
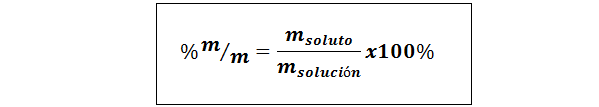
Wo mgelöst und MLösung jeweils die Masse des gelösten Stoffes und die Lösung darstellen. Jede Masseneinheit kann verwendet werden (G, Mg, kg usw.) Solange beide Massen in derselben Einheit ausgedrückt werden.
%Gewicht/Volumen (%P/V) oder Masse/Volumen (%m/v)
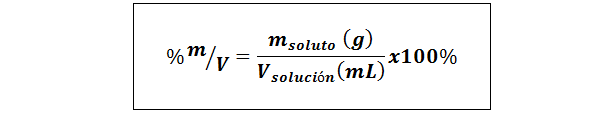
Wo mgelöst Es ist die Masse der Lösung in Gramm und vLösung Es ist das Volumen der Lösung, in diesem Fall in Millilitern.
% Volumen/Volumen (% v/v)

Wo vgelöst und vLösung repräsentieren jeweils das Volumen des gelösten Stoffes und der Lösung. In diesem Fall kann jede Einheit verwendet werden, um diese Bände auszudrücken, solange sie für beide gleich ist.
Teile pro Million Gewicht/Gewicht (ppmp/p) oder Masse/Masse (ppmm/m)
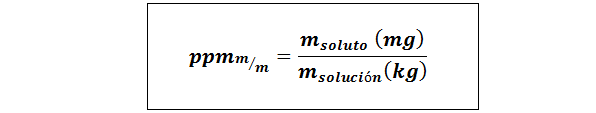
Wo mgelöst und MLösung Sie repräsentieren die Masse des gelösten Stoffes und die Lösung in Milligramm bzw. Kilogramm.
Teile pro Million Gewicht/Volumen (ppmp/v) oder Masse/Volumen (ppmm/v)
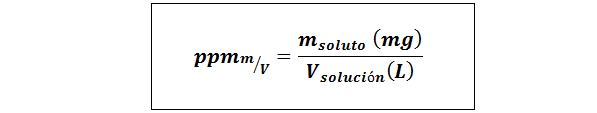
Wo mgelöst Es ist die Masse der Lösung in Milligramm und vLösung Es ist das Volumen der Lösung, in diesem Fall in Litern.
Teile pro Million Volumen/Volumen (ppmV/v)
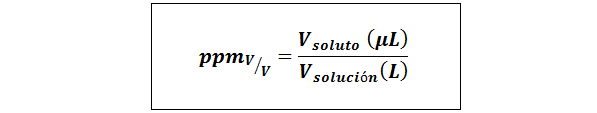
Wo vgelöst und vLösung Sie sind das Volumen des gelösten Stoffes und die Lösung in Mikrolitern bzw. Litern.
Formeln der chemischen Konzentrationseinheiten
Im Falle von chemischen Konzentrationseinheiten wird die Menge der Komponenten der Lösung, insbesondere des gelösten gelösten Stoff. Diese Mengen haben die reale Anzahl von Partikeln (Atome, Moleküle oder Ionen, so wie es der Fall sein mag).
Diese Mengen können nicht einfach durch das Wiegen oder Messen des Substanzenvolumens bekannt sein, aber es ist notwendig, die Zusammensetzung oder chemische Formel der Verbindungen zu kennen, um die Konzentration zu bestimmen. Dies ist der Hauptgrund, warum sie chemische Konzentrationen genannt werden.
Als nächstes werden die verschiedenen Formeln vorgestellt, um die vier am häufigsten verwendeten chemischen Konzentrationen zu berechnen:
Molarität (m)
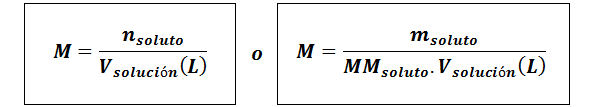
Wogelöst Sie sind die Maulwürfe von Stoff, mgelöst repräsentiert die Masse des gelösten Stoffes in Gramm, mmgelöst ist seine Molmasse und vLösung Es ist das Volumen der Lösung in Litern.
Molalität (m)
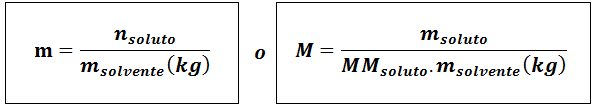
Wogelöst Sie sind die Maulwürfe von Stoff, mgelöst repräsentiert die Masse des gelösten Stoffes in Gramm, mmgelöst Es ist seine Molmasse und mLösungsmittel Es ist die Masse des Lösungsmittels in Kilogramm.
Kann Ihnen dienen: SolvationMolfraktion (x)
Die molare Fraktion kann sowohl für den gelösten als auch für das Lösungsmittel berechnet werden. Der Molfraktion des gelösten Stoffes lautet:
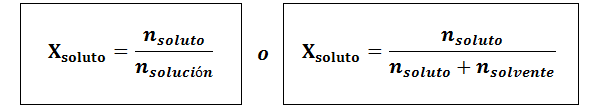
Das Lösungsmittel ist:
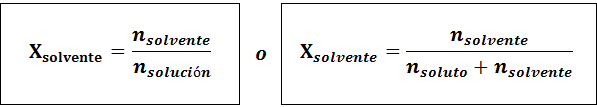
Die Beziehung zwischen beiden molaren Fraktionen ist:
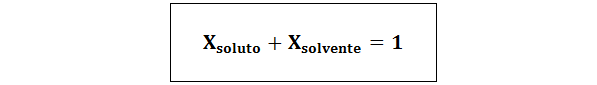
In allen Fällen ngelöst, NLösung und nLösungsmittel sind die Maulwürfe von gelösten, Lösung bzw. Lösungsmittel.
Normalität (n)
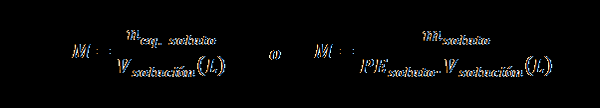
Hier nGl. gelöst repräsentiert die Anzahl der Äquivalent des gelösten Stoffes, mgelöst repräsentiert die Masse des gelösten Stoffes, PEgelöst Es ist das äquivalente Gewicht des gelösten Stoffes und vLösung Es ist das Volumen der Lösung in Litern.
Beispiele für chemische Konzentration
- Die Salzkonzentration in Meereswasser beträgt 35 g/l, was einer Molarität von 0,60 mol/l entspricht.
- Die durchschnittliche Blutzuckerkonzentration liegt zwischen 82 mg/dl und 110 mg/dl. Diese Konzentrationen entsprechen einem einfachen Titel bei 0,82 g/l und 1,10 g/l und in Molarität bei 4,4.10-3 mol/l und 6.1.10-3 mol/l.
- Die Luft kann als gasförmige Lösung angesehen werden, die hauptsächlich durch Stickstoff und Sauerstoff gebildet wird, wobei das Lösungsmittel Stickstoff ist. Diese Gaslösung enthält einen Sauerstoff- und Stickstofffraktion von 0,22 von ungefähr 0,78.
- Stahl ist eine Legierung zwischen Eisen und Kohlenstoff. Obwohl sie keine streng Lösungen sind, sind dies homogene feste Gemische, die normalerweise eine Kohlenstoffkonzentration in der Größenordnung von 0,03% und 1.075% in der Masse enthalten.
- Trotz seiner verheerenden Auswirkungen auf die Umwelt und auf die Gesundheit von Menschen sind die Konzentrationen vieler Schadstoffe in der Regel erheblich niedrig. Ein Beispiel ist die maximale Konzentration von Arsengiftmetall im Wasser. Die Weltgesundheitsorganisation (WHO) stellte fest, dass Trinkwasser keine Arsenkonzentration von mehr als 10 ppbB M/V (Teile pro Milliarde oder Nanogramm pro Liter) enthalten sollte. Diese Konzentration entspricht 0.010 ppm m/v.
Verweise
- BBC (s. F.). Lösungskonzentration - Berechnungen in der Chemie - AQA - GCSE Chemistry (Single Science) Review - AQA. BBC genommen.CO.Vereinigtes Königreich.
- Hier ist, was Konzentration in der Chemie bedeutet (2020). Aus Thakedco abgerissen.com.
- Librettexts (2022). 4.5: Konzentration von Lösungen. Entnommen von Chem.Librettexts.Org.
- Mandal, a., Md. (2021). Normale Blutzuckerwerte. Aus dem Nachrichten medizinisch entnommen.Netz.
- Chemikalien.Netz (s. F.). Chemische Konzentrationen. Aus Chemie entnommen.Netz.

