Kernel Elektronische Konfigurationskonstruktion, Beispiele
- 4740
- 1490
- René Riediger
Der Elektronische Kernelkonfiguration oder kompakt ist, dass die Quantennotationen der Anzahl der Elektronen und ihrer Energie -Sub -Levels durch die Symbole von edlen Gasen in quadratischen Klammern abgekürzt werden. Es ist sehr nützlich beim Schreiben elektronischer Konfigurationen für ein bestimmtes Element, da es einfach und schnell ist.
Das Wort "Kernel" bezieht sich normalerweise auf die elektronischen inneren Schichten eines Atoms; Das heißt, diejenigen, in denen ihre Elektronen nicht aus Valencia stammen und daher nicht an der chemischen Bindung teilnehmen, obwohl sie die Eigenschaften des Elements definieren. Metaphorisch gesehen wäre der Kernel das Innere der Zwiebel, wobei seine Schichten aus einer Reihe wachsender Orbitale in Energie bestehen.
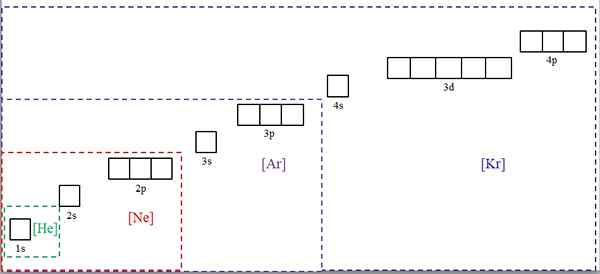
 Elektronische Konfigurationen, die mit den Symbolen von edlen Gasen abgekürzt wurden. Quelle: Gabriel Bolívar.
Elektronische Konfigurationen, die mit den Symbolen von edlen Gasen abgekürzt wurden. Quelle: Gabriel Bolívar. Das überlegene Bild zeigt chemische Symbole für vier der edlen Gase in quadratischen Klammern und mit unterschiedlichen Farben: [er] (grün), [ne] (rot), [ar] (lila) und [kr] (blau) (blau).
Jedes seiner gepunkteten Frames enthält Boxen, die die Orbitale darstellen. Je größer, desto größer ist die Anzahl der elektronen, die enthalten; Dies bedeutet wiederum, dass die elektronischen Konfigurationen von mehr Elementen mit diesen Symbolen vereinfacht werden können. Dies spart Zeit und Energie, indem alle Notationen geschrieben werden.
[TOC]
Bauordnung
Bevor Sie die elektronischen Kernel -Konfigurationen verwenden, ist es zweckmäßig, die richtige Reihenfolge zu überprüfen, um diese Konfigurationen zu erstellen oder zu schreiben. Dies wird gemäß der diagonalen Regel oder dem Moeller -Diagramm (in einigen Teilen des Regens genannt) regiert). Quantennotationen bleiben wie folgt wie folgt wie folgt:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Kann Ihnen dienen: Grundlegale Salze: Formel, Eigenschaften, Nomenklatur, BeispieleDiese Reihe von Quantennotationen sieht erschöpft aus; Und es wäre noch mehr, wenn Sie es alle Zeiten schreiben müssten, um die elektronische Konfiguration eines beliebigen Elements darzustellen, das in Zeit 5 gefunden wurde. Beachten Sie, dass die Reihe leer von Elektronen ist; Es gibt keine Zahlen bei den höheren Rechten (1s22s22 p6…).
Es sollte daran erinnert werden, dass die Orbitale S kann zwei Elektronen "Host" (ns2). Die Orbitale P Insgesamt gibt es drei (siehe die drei obigen Kisten), damit sie sechs Elektronen (NP6). Und schließlich die Orbitale D Es gibt fünf und die F sieben mit insgesamt zehn (nd10) und vierzehn (NF14) Elektronen jeweils.
Elektronische Konfigurationsabkürzung
Die vordere Reihe von Quantennotationen ist jedoch mit Elektronen gefüllt:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Wie viele Elektronen sind insgesamt? 118. Und welches Element entspricht einer so riesigen Menge an Elektronen in seinem Atom? Zu edler Oganer Gas, OG.
Angenommen, es gibt ein Element mit einer Quantenzahl Z, die 119 entspricht. Dann wäre die elektronische Valencia -Konfiguration 8s1; Aber was wäre seine vollständige elektronische Konfiguration?
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6 8s1
Und was wäre Ihre elektronische Kernelkonfiguration, die Kompakte? Das:
[OG] 8S1
Beachten Sie die offensichtliche Vereinfachung oder Abkürzung. Im Symbol [og] werden alle oben geschriebenen 118 Elektronen gezählt, sodass dieses ungewisse Element 119 Elektronen enthält, von denen nur einer von Valencia stammt (es würde sich unter dem Francio in der Periodenzüchttabelle befinden).
Kann Ihnen dienen: Was ist eine gesättigte Lösung?? (Mit Beispielen)Beispiele
Allgemein
Nehmen wir jetzt an, dass Sie die Abkürzung schrittweise durchführen möchten:
[Er] 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Beachten Sie, dass 1s2 Es wurde durch [er] ersetzt. Das nächste edle Gas ist das Neon, das 10 Elektronen hat. Wenn Sie dies wissen, setzt sich die Abkürzung fort:
[Ne] 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Folgen Sie dann dem Argon mit 18 Elektronen:
[Ar] 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Da das nächste edle Gas der Kripton ist, werden weitere 36 Elektronen fortgeschritten:
[KR] 5S2 4d10 5 p6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Das Xenon hat 54 Elektronen, und deshalb bewegen wir die Abkürzung in das 5P -Orbital:
[Xe] 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Zu diesem Zeitpunkt wird die elektronische Konfiguration immer zum NP -Orbital abgekürzt. Das heißt, edle Gase haben diese Orbitale voller Elektronen. Und folgen Sie schließlich dem Radon mit 86 Elektronen, sodass wir das 6P -Orbital abkürzen:
[RN] 7S2 5f14 6d10 7p6
Sauerstoff
Sauerstoff hat acht Elektronen, die seine vollständige elektronische Konfiguration ist:
1s22s22 p4
Die einzige Abkürzung, die wir verwenden können, ist [er] von 1s2. Somit lautet seine elektronische Kernelkonfiguration:
[Er] 2s22 p4
Kalium
Kalium verfügt über neunzehn Elektronen, die seine vollständige elektronische Konfiguration ist:
Kann Ihnen dienen: Woher kommt Plastik?? Geschichte und Typen1s2 2s2 2 p6 3s2 3p6 4s1
Beachten Sie, dass wir das Symbol [er] verwenden können, um diese Konfiguration abzukürzen. sowie [ne] und [ar]. Letzteres ist das, was verwendet wird, weil Argon das edle Gas ist, das es dem Kalium am nächsten liegt. Daher bleibt seine elektronische Kernelkonfiguration:
[Ar] 4s1
indisch
Der Inder hat vierzig Elektronen, die seine vollständige elektronische Konfiguration ist:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p1
Da das Kripton das nächstgelegene edle Gas ist, das dem Inder vorausgeht, wird das [KR] -Symbol für die Abkürzung verwendet, und seine elektronische Kernel -Konfiguration ist:
[KR] 5S2 4d10 5 p1
Obwohl 4D -Orbitale nicht offiziell zum indischen Kernel gehören, greifen ihre Elektronen nicht (zumindest unter normalen Bedingungen) in ihre Metallbindung ein, sondern die von 5S- und 5p -Orbitalen.
Wolfram
Der Wolfram (oder Wolframio) verfügt über 74 Elektronen und seine vollständige elektronische Konfiguration lautet:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 d4
Auch hier suchen wir nach dem nächsten edlen Gas. In seinem Fall entspricht es Xenón, der seine 5p -Orbitale vollständig hat. Somit ersetzen wir die Quantennotationen durch das Symbol [XE], und wir werden endlich seine elektronische Kernelkonfiguration haben:
[Xe] 6s2 4f14 5 d4
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Pat Thayer. (2016). Elektronenkonfigurationsdiagramme. Erholt von: ChemistryApp.Org
- Helmestine, Anne Marie, ph.D. (5. Dezember 2018). Edle Gas -Kerndefinition. Erholt von: thoughtco.com/
- Wikipedia. (2019). Elektronische Konfiguration. Geborgen von: ist.Wikipedia.Org
- « Uranium Disco -Geschichte und Sänger, die sie gewonnen haben
- Tuskegee -Experimentiergeschichte, Motive und Kritik »

