Externe elektronische Konfiguration
- 2320
- 369
- Ibrahim Steuk
 Elektronische Orbitale. Quelle: Patricia.Fidi, Wikimedia Commons
Elektronische Orbitale. Quelle: Patricia.Fidi, Wikimedia Commons Was ist externe elektronische Konfiguration?
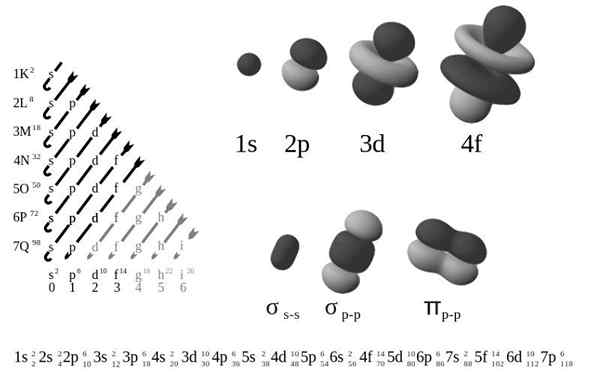
Der Externe elektronische Konfiguration, Auch als elektronische Struktur bezeichnet, ist es die Anordnung von Elektronen auf Ebenen und sub -Energie um einen Atomkern. Die Ebenen sind von 1 bis 7 und die Sub -Levels sind S, P, D und F.
Laut Bohrs altem Atommodell belegen Elektronen in den Umlaufbahnen um den Kern, von der ersten Schicht, die dem Kern, K, bis zur siebten Schicht, q, die am weitesten am.
In Bezug auf ein raffinierteres Quantenmechanikmodell werden K-Q-Schichten in eine Reihe von Orbitalen unterteilt, von denen jede von nicht mehr als ein paar Elektronen besetzt werden kann.
In der Regel wird die elektronische Konfiguration verwendet, um die Orbitale eines Atoms in seinem grundlegenden Zustand zu beschreiben, kann aber auch ein Atom verwendet werden.
Viele der physikalischen und chemischen Eigenschaften der Elemente können mit ihren einzigartigen elektronischen Konfigurationen korreliert werden. Valencia -Elektronen, Elektronen in der äußersten Schicht, sind der entscheidende Faktor für die einzigartige Chemie des Elements.
Grundlegende Konzepte elektronischer Konfigurationen
Bevor Sie den Orbitalen den Elektronen eines Atoms zuweisen, muss man sich mit den grundlegenden Konzepten elektronischer Konfigurationen vertraut machen. Jedes Element der Periodenzüchter besteht aus Atomen, die aus Protonen, Neutronen und Elektronen bestehen.
Die Elektronen weisen eine negative Belastung auf und befinden sich um den Kern des Atoms in den Elektronenorbitalen, definiert als das Volumen des Raums, in dem das Elektron innerhalb von 95% ermittelt werden kann.
Die vier verschiedenen Arten von Orbitalen (S, P, D und F) haben unterschiedliche Möglichkeiten, und ein Orbital kann maximal zwei Elektronen enthalten. Orbitale P, D und F haben unterschiedliche Sub -Levels, sodass sie mehr Elektronen enthalten können.
Kann Ihnen dienen: Batchreaktor: Eigenschaften, Teile, AnwendungenWie angegeben ist die elektronische Konfiguration jedes Elements für seine Position in der Periodenzüchter einzigartig. Das Energieniveau wird durch den Zeitraum bestimmt und die Anzahl der Elektronen wird durch die Atomzahl des Elements angegeben.
Orbitale auf unterschiedlichen Energieniveaus ähneln einander, belegen jedoch verschiedene Bereiche im Weltraum.
Das 1S -Orbital und das Orbital 2S haben die Eigenschaften eines Orbitals (Funkknoten, Wahrscheinlichkeiten des kugelförmigen Volumens, können nur zwei Elektronen enthalten usw. enthalten.). Aber ebenso wie in verschiedenen Energieniveaus belegen sie unterschiedliche Räume um den Kern. Jedes Orbital kann durch bestimmte Blöcke in der Periodenzüchttabelle dargestellt werden.
Der S -Block ist der Bereich von alkalischen Metallen, einschließlich Helium (Gruppen 1 und 2), Block D sind Übergangsmetalle (Gruppen 3 bis 12), Block P sind die Elemente der Hauptgruppe der Gruppen 13 a 18 und Block F sind sind Die Reihe von Lantaniden und Aktiniden.
Aufbau -Prinzip
Aufbau kommt aus dem deutschen Wort Aufbauen, Was bedeutet "Build". Im Wesentlichen bauen wir beim Schreiben von Elektronenkonfigurationen Elektronenorbitale, während wir von einem Atom zum anderen voranschreiten.
Wenn wir die elektronische Konfiguration eines Atoms schreiben, werden wir die Orbitale in zunehmender Reihenfolge der Atomzahl füllen.
Das Aufbau -Prinzip stammt aus Paulis Ausschlussprinzip, das besagt, dass es in einem Atom keine zwei Fermionen (zum Beispiel Elektronen) gibt. Sie können den gleichen Satz von Quantenzahlen haben, daher müssen sie auf höheren Energieniveaus "akkumulieren".
Die Art und Weise, wie sich die Elektronen ansammeln, ist ein Elektronenkonfigurationsproblem.
Die stabilen Atome haben so viele Elektronen wie die Protonen im Kern. Die Elektronen treffen sich in Quantenorbitalen um den Kern und nach vier Grundregeln, die als AUFBAU -Prinzip bezeichnet werden.
Kann Ihnen dienen: Bariumchlorid (BACL2)1. Es gibt keine zwei Elektronen im Atom, das von den gleichen vier Quantenzahlen n, l, m und s geteilt wird.
2. Elektronen werden zunächst die Orbitale der niedrigsten Energieniveau belegen.
3. Die Elektronen füllen die Orbitale immer mit der gleichen Spin -Nummer. Wenn die Orbitale voll sind, beginnt sie.
4. Elektronen füllen Orbitale für die Summe der Quantennummern n und l. Orbitale mit gleichen Werten (n + l) werden zuerst mit niedrigeren N -Werten gefüllt.
Die zweite und vierte Regeln sind im Grunde die gleichen. Ein Beispiel für Regel vier wären Orbitale 2p und 3s.
Ein Orbital 2p ist n = 2 und l = 2 und ein 3S -Orbital ist n = 3 und l = 1. (N + l) = 4 in beiden Fällen, aber das 2p -Orbital hat die niedrigste Energie oder einen niedrigeren Wert und wird vor Schicht 3s gefüllt.
Glücklicherweise können Sie das Moeller -Diagramm verwenden, um Elektronen zu füllen. Das Diagramm wird gelesen, indem die Diagonalen aus 1s ausgeführt werden.
 Moeller Diagramm. Quelle: Gabriel Bolívar
Moeller Diagramm. Quelle: Gabriel Bolívar Jetzt, da bekannt ist, dass die Reihenfolge der Orbitale gefüllt ist, ist das einzige, was bleibt.
Orbitale haben einen möglichen Wert von ml 2 Elektronen enthalten
P -Orbitale haben 3 mögliche Werte von ml 6 Elektronen enthalten
Orbitale haben 5 mögliche Werte von ml 10 Elektronen enthalten
F -Orbitale haben 7 mögliche Wertel 14 Elektronen enthalten
Dies ist alles, was erforderlich ist, um die elektronische Konfiguration eines stabilen Atoms eines Elements zu bestimmen.
Nehmen Sie zum Beispiel das Stickstoffelement. Stickstoff hat sieben Protonen und damit sieben Elektronen. Das erste Orbital ist das Orbital 1S.
Ein Orbital S hat zwei Elektronen, so dass noch fünf Elektronen übrig sind. Das nächste Orbital ist das 2S -Orbital und enthält die nächsten beiden. Die drei endgültigen Elektronen gehen zum 2P -Orbital, das bis zu sechs Elektronen enthalten kann.
Kann Ihnen dienen: CarboxymethylcelluloseBedeutung der externen elektronischen Konfiguration
Elektronenkonfigurationen spielen eine wichtige Rolle bei der Bestimmung der Atomeigenschaften.
Alle Atome derselben Gruppe haben die gleiche externe elektronische Konfiguration mit Ausnahme der Atomzahl N, weshalb sie ähnliche chemische Eigenschaften haben.
Einige der Schlüsselfaktoren, die die Atomeigenschaften beeinflussen.
Die meisten Atomeigenschaften können mit dem Grad der Anziehung zwischen den Elektronen außerhalb des Kerns und der Anzahl der Elektronen in der äußersten Elektronenschicht, der Anzahl der Valenzelektronen, zusammenhängen.
Die Elektronen der äußeren Schicht sind solche, die kovalente chemische Bindungen bilden können, die die Fähigkeit haben, Kationen oder Anionen zu bilden, und solche, die den chemischen Elementen den Oxidationszustand geben.
Sie werden auch den Atomradius bestimmen. Wenn n größer wird, nimmt der Atomradius zu. Wenn ein Atom ein Elektron verliert, wird es eine Kontraktion des Atomradius aufgrund der Abnahme der negativen Belastung um den Kern geben.
Die Elektronen der äußeren Schicht werden durch die Valencia -Verbindungstheorie, die Theorie des kristallinen Feldes und die molekulare Orbitalentheorie berücksichtigt, um die Eigenschaften der Moleküle und die Hybridisierungen der Bindungen zu erhalten.
Verweise
- Aufbau Main. Chem erholt sich.Librettexts.Org.
- Bozeman Science. Elektronenkonfiguration. Von YouTube geborgen.com.
- Elektronenkonfigurationen und die Eigenschaften von Atomen. Von Oneonta geborgen.Edu.

