Geschwindigkeitskonstante

- 2391
- 592
- Frederike Birkemeyer
Was ist die Geschwindigkeitskonstante?
Der Geschwindigkeitskonstante Es handelt.
Während die Reagenzien verbrauchen die Reaktionsgeschwindigkeiten, nehmen auch ab. Aus diesem Grund werden in den Berechnungen der Geschwindigkeitskonstante, die durch das Symbol 'k' dargestellt werden.

Die chemische Kinetik zeigt an, dass diese Konstante von den Reaktionsordnungen der Reagenzien abhängt, deren Konzentrationen die Geschwindigkeit der Reaktion verändern werden. Andererseits hängt K nach der Arrhenius -Gleichung auch von der Temperatur und Aktivierungsenergie für die Reaktion ab.
Aus diesem Grund wird gesagt, dass die Geschwindigkeitskonstante keine echte Konstante ist, da sie mit der Temperatur und auch von Katalysatoren vorhanden ist, die die Aktivierungsenergie modifizieren. Daher gibt es nicht viele Tabellen, in denen sie für bestimmte Reaktionen (und Bedingungen) kommen,.
Zum Beispiel für eine Reaktion, bei der A und B reagieren, jeweils eine Reaktionsordnung von 1, die Konstante berichtete K bis 25 ° C, und bei Zugabe einer bestimmten Katalysatormenge ist dies bei der Reaktion nicht gleich, wenn die Reaktion gleich ist wird an einer Temperatur von 26 oder 27 ° C hergestellt. Die geringste Variation beeinflusst den Wert von k, der nur während der für Experimente festgelegten Bedingungen konstant ist.
Wie man die Geschwindigkeitskonstante berechnet?
Experimentieren
Die Bestimmung des Wertes der Geschwindigkeitskonstante einer Reaktion wird experimentell gemacht. Wenn Sie beispielsweise den Wert der Geschwindigkeitskonstante für eine Reaktion der Form bestimmen möchten:
A +b → c
Für die Schaffung des Wertes von k können drei Reaktionen mit folgenden Unterschieden durchgeführt werden: In Reaktion 2 ist die anfängliche Konzentration von Reagenz A konstant [a], wird jedoch verdoppelt, beispielsweise die Konzentration des Reagenzus B [ B].
In der Reaktion 3 [a] wird im Vergleich zu Reaktion 1 verdoppelt, wobei konstant [b] hält [B].
Daher wird eine Konzentrationsdabelle gebaut, die dazu dient, die anfänglichen Geschwindigkeiten zwischen mehreren Experimenten zu vergleichen. Dies mit dem Zweck der Bestimmung von Reaktionsordnungen und nacheinander, um die Geschwindigkeitskonstante zu berechnen.
Kann Ihnen dienen: Aluminiumhydroxid: Struktur, Eigenschaften, Verwendungen, RisikenReaktionsordnungen
Erste Berechnung
Für die vorherige Reaktion wird die Geschwindigkeit durch die Gleichung ausgedrückt:
Reaktionsgeschwindigkeit = k · [a]X· [B]Und
Wobei 'x' e 'und' den Reaktionsordnungen für Reagenzien A und B entsprechen.
Um die Werte der Reaktionsordnungen zu bestimmen, muss ein Vergleich zwischen der Reaktion 2 und 1 sowie zwischen der Reaktion 3 und 1 durchgeführt werden.
Beim Vergleich der Reaktion 1 mit dem 2 konnte beispielsweise beobachtet werden.
Dann: Der Anteil von [b] zwischen den Reaktionen 2 und 1 beträgt 2 sowie der Anteil zwischen den Geschwindigkeiten der Reaktionen. Anschließend kann der Ordnungswert der Reaktion in Bezug auf B (Exponent und) durch den folgenden Ansatz erhalten werden:
 Berechnung der Reaktionsreihenfolge und '. Quelle: Gabriel Bolívar.
Berechnung der Reaktionsreihenfolge und '. Quelle: Gabriel Bolívar. Die Geschwindigkeit des Experiments 2 ist zweimal schneller als die Geschwindigkeit des Experiments 1. Daher werden wir die beiden oben genannten Gleichungen teilen: Wir werden:
2 = 2Und
Daher 'und' Vale 1, in der Lage zu sein, zu dem Schluss zu kommen, dass die Reihenfolge der Reaktion in Bezug auf Reagenz B von erster Ordnung ist.
Zweite Berechnung
Ebenso gehen wir mit dem Reagenz A für die Berechnung von 'x' fort:
 Berechnung der Reaktionsreihenfolge 'x'. Quelle: Gabriel Bolívar.
Berechnung der Reaktionsreihenfolge 'x'. Quelle: Gabriel Bolívar. Die Geschwindigkeit des Experiments oder der Reaktion 3 ist viermal höher als das Experiment oder die Reaktion 1. Deshalb:
4 = 2X
ENTWEDER
22 = 2X
Und der Wert von x beträgt 2, daher ist die Reaktion zweiter Ordnung in Bezug auf das Reagenz auf.
Endgültige Lichtung
Dann kann der Wert der Geschwindigkeitskonstante basierend auf einer der Reaktionen festgelegt werden:
Reaktionsgeschwindigkeit = k · [a]2· [B]
Genug, um experimentelle Werte einzuführen und K: klares K:
K = Reaktionsgeschwindigkeit / ([a]2· [B])
Beispiele
Die folgenden Beispiele dienen als Einführung, bevor die Übungen aus dem folgenden Abschnitt gelöst wurden.
Beispiel 1
In einer chemischen Reaktion:
a) Wenn die anfängliche Konzentration eines Reagens die Reaktionsgeschwindigkeit verdoppelt: Wie ist die Reihenfolge der Reaktion in Bezug auf dieses Reagenz?
b) Wenn die Erhöhung der Reagenzkonzentration zu einem Anstieg der Geschwindigkeit in einem Faktor von 8 führt, wie wäre es dann in der Reihenfolge der Reaktion?
c) Wenn die Konzentration des Reagenzus eine Veränderung erfährt und die Geschwindigkeit gleich bleibt: Wie ist die Reihenfolge der Reaktion in Bezug auf das Reagenz?
Es kann Ihnen dienen: Cycopropan (C3H6)In a) ist der Anteil der Reaktionsgeschwindigkeiten gleich und der Anteil der Reagenzkonzentrationen entspricht 2X,
2 = 2X
Daher beträgt x = 1 und die Reihenfolge der Reaktion in Bezug auf das Reagenz 1.
In b) Der Anteil der Reaktionsgeschwindigkeit beträgt 8 (23) und der Anteil der Reagenzkonzentrationen ist gleich 2X,
23 = 2X
Daher beträgt x = 3 und die Reihenfolge der Reaktion in Bezug auf das Reagenz 3-
Während in c) die Geschwindigkeit der Reaktion unabhängig von der Konzentration des Reagenzs ist, ist die Reaktionsordnung in Bezug auf das Reagenz Null.
Beispiel 2
Die Reaktion:
2 Nr2 + ENTWEDER2 → 2 Nr2
Es hat den Ausdruck des folgenden Geschwindigkeitsgesetzes:
Reaktionsgeschwindigkeit = k · [Nein2]2·ENTWEDER2.
Was ist die globale Reihenfolge der Reaktion?? Welche Einheiten hätten k?
Die Reihenfolge der Reaktion bezüglich oder2 Es ist 1 und die Reihenfolge der Reaktion in Bezug auf nicht2 Es ist 2, also ist die globale Reihenfolge der Reaktion die Summe dieser Werte, dh 2 + 1 = 3.
Die Geschwindigkeit der Reaktion hat M/S -Einheiten, und die Konzentrationen der Reagenzien werden in m exprimiert. Eine Analyse der Einheiten durchführen, die wir haben werden:
k = Reaktionsgeschwindigkeit / ([nein2]2·[ENTWEDER2]
= (M / s) / (m3)
= s-1M-2
Gelöste Übungen
Übung 1
Die Daten der folgenden Reaktion wurden bei 25 ° C erhalten:
A +2 b → c +2 d
Was ist der Ausdruck des Geschwindigkeitsgesetzes dieser Reaktion?? Was ist der Wert Ihrer Geschwindigkeitskonstante??
Reaktionsberechnungen
Experimentelle Daten sind:
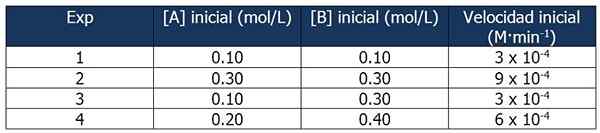 Cinetic -Daten der Übung 1. Quelle: Gabriel Bolívar.
Cinetic -Daten der Übung 1. Quelle: Gabriel Bolívar. Mit dem Vergleich der Experimente 1 und 3 können Sie die folgenden Schlussfolgerungen ziehen:
Anteil zwischen den Reaktionen der Reaktionen 3 und 1:
3 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 1
Der Anteil zwischen B -Konzentrationen beträgt jedoch:
(0.3 mol / l) / (0).1 mol/l) = 3
Die Geschwindigkeit der Reaktion ist unabhängig von der Konzentration von B, da ihr Anstieg sie nicht beeinflusst. Daher ist die Reihenfolge der Reaktion in Bezug auf Reagenz B Null.
Andererseits ermöglicht der Vergleich der Reaktionen 4 und 1 die folgenden Schlussfolgerungen:
6 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 2
Inzwischen ist der Anteil zwischen [A] der Reaktionen 4 und 1 gleich:
Kann Ihnen dienen: 5 Eigenschaften homogener Gemische(0.20 mol / l) / (0).10 mol/l) = 2X
Dann wird die Beziehung zwischen den Proportionen:
2 = 2X
x = 1
Daher ist der Ausdruck des Geschwindigkeitsgesetzes:
Reaktionsgeschwindigkeit = k · [a]
B wird nicht eingenommen, weil die Reihenfolge der Reaktion Null ist.
Berechnung von k
Wir können die Geschwindigkeitskonstante aus allen kinetischen Daten berechnen. Verwenden wir Experiment 1:
K = Reaktionsgeschwindigkeit / [a]
= 3 x 10-4 M · min-1 / 0.10 m
= 3 x 10-3 oder 0.003 min-1
Übung 2
Die Reaktionsgeschwindigkeitsdaten wurden bei einer bestimmten Temperatur erhalten.
2 Clo2 (ac) +2 oh- (ac) → clo3- (ac) +clo2 (Ac) +h2Oder (l)
Reaktionsberechnungen
Experimentelle Daten sind:
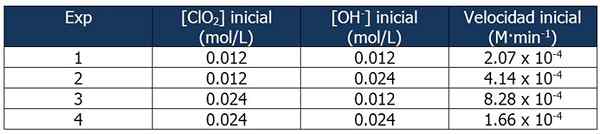 Cinetic -Daten zu Übung 2. Quelle: Gabriel Bolívar.
Cinetic -Daten zu Übung 2. Quelle: Gabriel Bolívar. Der Anteil zwischen den Reaktionsgeschwindigkeiten und der Reaktion 1 beträgt:
4.14 x 10-4 M · min-1 / 2.07 x 10-4 M · min-1 = 2
Und der Anteil der OH -Konzentrationen- Zwischen den Reaktionen 2 und 1 entspricht:
(0,024 mol/l)/(0,012 mol/l) = 2X
Der Exponent 'x' repräsentiert die Reihenfolge der Reaktion in Bezug auf das OH -Reagenz-. Die Beziehung zwischen berechneten Anteilen kann wie folgt dargestellt werden:
2 = 2X
x = 1
Daher die Reihenfolge der Reaktion in Bezug auf das OH -Reagenz- ist gleich 1.
In Reaktion 3 wird die CLO -Konzentration verdoppelt2 der Reaktion 1, während die Konzentration von OH- Bleibt konstant.
Anteil zwischen den Reaktionen der Reaktionen 3 und 1:
(8.28 x 10-4 M · min-1) / (2.07 x 10-4 M · min-1) = 4 (22)
Und der Anteil von [clo2] zwischen den Reaktionen 3 und 1 entspricht:
(0,024 mol/l)/(0,012 mol/l) = 2Und
Der Exponent 'und' repräsentiert die Reihenfolge der Reaktion in Bezug auf das CLO -Reagenz2.
Vergleich der Proportionen:
22 = 2Und
4 = 2Und
y = 2
Daher ist die Reaktion in Bezug auf das CLO -Reagenz der zweite2.
Der Ausdruck des Geschwindigkeitsgesetzes wird dann:
Reaktionsgeschwindigkeit = k · [CLO2]2· [Oh-]
Berechnung von k
Auch hier können wir K aus dem vorherigen Ausdruck anhand eines der kinetischen Daten für die Experimente berechnen. Wir werden Experiment 3 verwenden:
K = (8.28 x 10-4 M · min-1) / (0.024 m)2 (0.012 m)
= 119.79 min-1· M-2
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Wikipedia. (2020). Reaktionsgeschwindigkeit konstant. Abgerufen von: in.Wikipedia.Org
- Chemie Texas A & M Universität. (S.F.). Kinetik: Stichprobenrate -Berechnungen. Erholt von: Chem.Tamu.Edu
- Keith J. Laidler. (2020). Reaktionsrate. Britannica Encyclopaedia. Erholt von: Britannica.com
- Helmestine, Anne Marie, ph.D. (25. August 2020). Was ist die Geschwindigkeitskonstante in der Chemie? Erholt von: thoughtco.com
- Clark Jim. (2013). Ratenkonstanten und die Arrhenius -Gleichung. Erholt von: Chemguide.CO.Vereinigtes Königreich

