Coulombimetrie -Grundlagen, Typen, Anwendungen

- 3965
- 214
- Jasmine Kupprion
Der Coulombimetrie Es handelt sich um eine elektrochemische Analysetechnik, die bei der Durchführung einer erschöpfenden Elektrolyse besteht, damit der Analyte quantifiziert werden kann. das heißt, die Konzentration des Analyten auf die Probleme der Probleme durch seine vollständige Oxidation oder Reduzierung zu bestimmen. Im Gegensatz zur Potentiometrie ist es eine dynamische Technik, da der Strom frei durch elektrochemische Zellen fließen darf.
Wie der Name schon sagt, wird die elektrische Ladung Q in Coulomb -Einheiten C gemessen und mit der Konzentration des oxidierten oder reduzierten Analyten in den Elektrodenperipherien korreliert. Daher sind die Oxidationszustände der Analytänderung, die im Prozess eine Übertragung und Absorption der Elektronen auftritt, die die stöchiometrische Berechnung der gewünschten Konzentration ermöglicht.
 Rudimentäre Montage für eine Elektrolyse, bei der aufgrund des pH -Werts und der Komplexierung der vorhanden. Quelle: Steve Jurvetson von Menlo Park, USA, CC von 2.0, über Wikimedia Commons
Rudimentäre Montage für eine Elektrolyse, bei der aufgrund des pH -Werts und der Komplexierung der vorhanden. Quelle: Steve Jurvetson von Menlo Park, USA, CC von 2.0, über Wikimedia Commons In der Coulombimetrie wird eine Batterie oder ein Potentiostat verwendet, um den Strom oder das Potential auf Zellen zu steuern. Diese Zellen bestehen im Gegensatz zu potentiometrischen Aussagen aus einem Drei -Elektroden -System und sind mit einem Voltmeter und einem Amperemeter ausgestattet.
Coulombimetry bietet den Vorteil, dass Sie Abschlüsse ohne Vorbereitung oder Standardisierungsmuster durchführen können. Es ermöglicht auch die Quantifizierung sehr kleiner und begrenzter Analytenmengen, wie Metallkationen, anorganische Verbindungen und organische Verbindungen. Zum Beispiel gibt es ein Coulometer ausschließlich zur Messung von CO2 in Proben aus dem Meer gelöst.
Diese Technik bietet einen anderen analytischen Weg als volumetrisch und potentiometrisch, so viele Analysen, die je nach elektrochemischer Natur des Analytes Coulombimetrisch entwickeln können.
Theoretische Grundlagen der Coulombimetrie
Faraday -Gesetz
Die Coulombimetrie basiert auf dem Faradayschen Gesetz, das eine Beziehung zwischen der elektrischen Ladung einer elektrochemischen Zelle und der Menge an Analyten herstellt, die oxidiert oder verringert. Kennen Sie diese Last q sowie die Last eines Elektrons (1.6 · 10-19 C) Sie können die Anzahl der an einer Reaktion beteiligten Elektronen berechnen, NUnd-:
NUnd- = Q/e
Andererseits ist bekannt, dass ein Mol Elektronen (6).02 · 1023) Porta Eine elektrische Ladung von 96485 C, eine Zahl, die als Faraday Constant bezeichnet wird:
F = inZU
= 96485.3365 c/mol
Bequem zu sein, um die Anzahl der Elektronen abhängig von den Maulwürfen auszudrücken. Dank diesem können die stöchiometrischen Koeffizienten einer elektrochemischen Reaktion, Oxidation oder Reduzierung verwendet werden, unter Berücksichtigung, wie viele Mol von Elektronen die Spezies gewinnen oder verlieren.
Kann Ihnen dienen: Natriumphosphat: Struktur, Eigenschaften, Synthese, verwendetGrundlegende Berechnungen
Betrachten Sie beispielsweise die folgende chemische Gleichung:
Ox + 2e- → Netzwerk
Wenn wir messen, dass wir, wenn die gesamte OX -Spezies in ein Netzwerk reduziert wurde, die Mol von OX unter Verwendung von Umwandlungsfaktoren berechnen können:
xq · (mol e- /96485.3365 C) · (Mol Ox/ 2mol e-) = MOL OX
Das heißt, wie wir die elektrische Ladung für einen Mol Elektronen kennen, haben wir, wie viele Elektronen dem Last xq entsprechen. Aber wiederum werden alle 2 Mol dieser Elektronen verwendet, um 1 Mol Ox zu oxidieren.
Diese Argumentation bewirkt eine direkte Formel, auch wenn sie nicht empfohlen wird, sie auswendig zu lernen, sondern in der Lage zu sein, sie so abzuleiten, wie es getan wurde:
N = Q/(fNUnd-)
Wo NUnd- Es ist die Anzahl der Mol von Elektronen in der chemischen Gleichung.
Vorausgesetzt, dass es unabhängig von der Art der Coulombimetrie berechnet werden kann, können die Mol des OX- oder Netzwerkanalyten bestimmt werden. Solange die Effizienz des Stroms 100% beträgt. Letzteres bedeutet, dass die gesamte Last, die das Produkt nur einer Transformation sein muss, ohne dass andere Spezies reduziert oder oxidiert werden.
Experimentelle Grundlagen der Coulombimetrie
Zellen
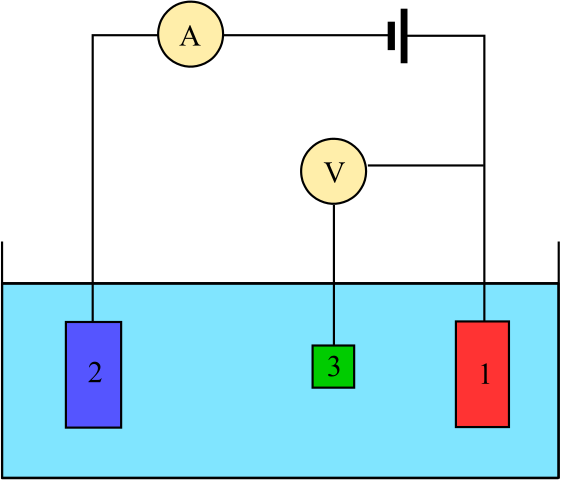 Diagramm für eine elektrochemische Zelle, die aus drei Elektroden besteht: der Referenz (3), dem Assistenten (2) und der Arbeit (1). Quelle: Adam Rędzikowski, CC BY-SA 3.0, über Wikimedia Commons
Diagramm für eine elektrochemische Zelle, die aus drei Elektroden besteht: der Referenz (3), dem Assistenten (2) und der Arbeit (1). Quelle: Adam Rędzikowski, CC BY-SA 3.0, über Wikimedia Commons Wir haben ein Diagramm für eine Zelle mit drei Elektroden, die üblicherweise in Coulombimetrischen Analysen verwendet wird. Die Redoxreaktion erfolgt unter den Arbeitselektroden (1) und dem Hilfsmittel (2). Unter ihnen sind zwei die Batterie angeschlossen, um die Potentiale auf die Zelle und den Amperemeter (A) anzuwenden, um die elektrischen Ströme zu messen.
Eine Referenzelektrode (3) ist jedoch erforderlich, um das Potenzial der Arbeitselektrode zu überwachen und somit die Variation des Potenzials für die Hilfselektrode zu kennen. Auf diese Weise kann das Potenzial der gesamten Zelle bestimmt werden undZelle, notwendig, um das Ende der Redoxreaktionen in einer der Arten der Coulombimetrie abzuschätzen.
Beachten Sie, dass zwischen der Arbeitselektrode und der Referenzelektrode aufgrund des Voltmeter mit hohem Impedanz (V) fast kein Flussstrom ist, dank dessen eine Lektüre des Potentials für die Arbeitselektrode vorhanden ist. Zwischen diesen beiden Elektroden haben wir ein System ähnlich wie eine potentiometrische Analyse: Es ist statisch und nicht dynamisch.
Es kann Ihnen dienen: Kernchemie: Geschichte, Studienbereich, Bereiche, AnwendungenPotenzial
Coulombimetrie ist sozusagen eine Elektrolyse, die für analytische und quantitative Zwecke durchgeführt wird. Daher ist die Rede davon, externe Potentiale, die von einer Batterie geliefert werden, zur Durchführung nichtspontaner elektrochemischer Reaktionen anzuwenden. Das heißt, diejenigen, die negative Potentiale haben.
Betrachten Sie beispielsweise die folgenden Reaktionen, die von ihren jeweiligen potenziellen Standards begleitet werden:
Cu2+ + 2e- ⇌ cu (s) eºNetz = +0.337 v
H2Oder ⇌ 1/2o2(g) + 2h+ + 2e- EºNetz = +1.230 V
Die Gleichung der globalen Reaktion gleich:
Cu2+ + H2Oder ⇌ cu (s) + 1/2o2(g) + 2h+ EºNetz = -0.893 v
Die Batterie muss ein Potenzial von 0 auftragen.893 V, so dass eine Kupferelektrode und die Bildung von Wasserstoffionen möglich sind. Dieses Potenzial ist das eZelle. In der Praxis muss jedoch ein Potential, das größer als berechnet ist, angewendet werden, da es Potentiale gibt, die sich der Entwicklung der Reaktion widersetzen:
UNDZelle = EKathode - UNDAnode - Op - ir - cp
Wo,
OP: Überpotential (kinetische Barriere)
IR: Ohmic (intrinsisches Potential für Zellen)
CP: Polarisation von Konzentrationen (Produkt der Abnahme der CU2+)
Arten von Coulombimetrie
Es gibt drei Arten von Coulombimetrie: amperostatisch, potentiostatisch und elektrogravimetrisch.
Amperostatisch oder galvanostatisch
In dieser Art von Coulombimetrie ist der Strom, der durch die Zelle läuft. Daher den Strom haben Yo Dank der Lektüre des Amperemeters und der Zeit des Zeitpunkts T Sobald die Elektrolyse endet, können wir die Last berechnen, die mit der Transformation des Analyten verbunden ist:
Q = Artikel
Eine Folge der Aufrechterhaltung der Stromkonstante ist, dass sich die Potential der Elektroden entweder positiv oder negativ ändern. Diese plötzliche Variation zeigt an, dass der Analyte vollständig reagiert hat, wenn die Elektrolyse stoppt und gemessen wird T. Dies ist die Grundlage für Coulometriegrade.
Wenn das Potential fortgesetzt oder hochgeladen wird, reagieren andere unerwünschte elektroaktive Spezies. Deshalb sollten die mit den Interessenstransformationen verbundenen Potenziale perfekt bekannt sein.
Potentiostatisch
Eine Möglichkeit, andere Arten zu verhindern. Hier tritt die potentiosotische Coulombimetrie ein. Im Gegensatz zur amperostatischen Coulombimetrie ist es jetzt der Strom, der sich im Laufe der Zeit ändert.
Kann Ihnen dienen: Toluol: Struktur, Eigenschaften, Verwendungen, ErhaltenAufgrund dieser technischen Konfiguration können wir das nicht direkt mit den Werten von berechnen Yo Und T; Der Strom nimmt im Laufe der Zeit ab. Dies liegt daran. Daher entspricht dies einem integralen Bereich unter der Grafikkurve Yo vs T.
Elektrografisch
Die elektrografische Coulombimetrie, einfach als elektrogravimetrie bezeichnet, ist eine Elektrolyse, in der sie nicht erforderlich ist, um Lasten oder elektrische Ströme zu messen. Stattdessen werden die Massen der Elektroden vor und nach der Elektrolyse gemessen.
Diese Technik gilt nur, wenn die Arten, die reduziert sind.
Anwendungen
Potentiostetisch
Potentiostetische Analysen ermöglichen es, eine Spezies selektiv eine Spezies in der Mitte einer Mischung zu reduzieren oder zu oxidieren. Beispielsweise werden sie verwendet, um die Konzentration der folgenden anorganischen Ionen in Spurengrößen oder in komplexen Matrizen zu bestimmen:
-Cu2+
-As3+
-CD2+
-CO2+
-Glaube2+ und Glaube3+
-Pb2+
-X (f-, Cl-, Br- und ich-)
-Weder2+
-Pu3+
-Ag+
-Sn2+
-Zn2+
-ODER6+
Diese Analysen können auch verwendet werden, um die Zusammensetzung einer Legierung zu bestimmen. Sobald die Säurelegierung gelöst ist, werden Zellpotentiale auf gestaffelte und kontrollierte Weise angewendet, wodurch die reduzierte Menge für jedes Metallkation festgelegt wird, das sie integriert.
Coulometrische Abschlüsse
In den Coulometriegraden werden Vermittlungsmittel verwendet, die sicherstellen, dass sie vollständig neutralisieren oder mit dem verbleibenden Analyten reagieren. Der Zweck davon besteht darin, potenzielle Variationen zu einem konstanten Strom zu verhindern, bei Kollateralreaktionen abgeleitet. Somit ist es möglich, zum Beispiel Ascorbinsäure unter Verwendung von Jod als Mediator.
Einige Metallkationen wie Ag+, EC3+, Glaube3+, Mn2+, Du3+, Cr2+, Sie können auch durch diese Grade bestimmt werden.
Andererseits können Säure-Base-Reaktionen diese Technik immer noch anwenden, da große Potentiale dazu führen, dass Wasser ionisch ist3ENTWEDER+ oder oh-, die von Titelagenten dienen, die in situ erzeugt werden; Das heißt, sie werden die Säuren oder die vorhandenen Basen neutralisieren.
Die co2 des Ozeans können die Niederschlagsreaktionen und die Bildung von Komplexen mit dem EDTA auch durch die Anwendung von Coulometriegräben analysieren, wobei Redoxindikatoren hinzugefügt werden, um den endgültigen Punkt der Elektrolyse hervorzuheben.
Verweise
- Tag, r., & Underwood, a. (1986). Quantitative analytische Chemie (Fünfter Aufl.). Pearson Prentice Hall.
- Skoog d.ZU., West d.M. (1986). Instrumentalanalyse. (Zweite Ed.). Inter -American., Mexiko.
- DR. Doug Stewart. (2020). Definition der Coulometrie. Erholt von: Chemicoolool.com
- Wikipedia. (2020). Coulometrie. Abgerufen von: in.Wikipedia.Org
- Harvey David. (5. Juni 2019). Coulometrische Methoden. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- « Methodologischer Rahmen, wie man es, Struktur, Beispiele schreibt
- Zeitgenössische Philosophie Herkunft, Merkmale, Strömungen, Autoren »

