Bowman -Kapselstruktur, Histologie, Funktionen
- 1800
- 116
- Said Ganzmann
Der Bowman -Kapsel Es repräsentiert das anfängliche Segment der tubulären Komponente des Nephrons, anátomo-funktionaler Einheit der Niere, in der die für die Urinproduktion vorgesehenen Prozesse durchgeführt werden und mit denen die Niere zur Erhaltung der Homöostase des Organismus beiträgt.
Es wurde zu Ehren des englischen Ophthalmologen und anatomistischen Doktors Sir William Bowman benannt, der seine Existenz entdeckte und seine histologische Beschreibung 1842 zum ersten Mal veröffentlichte.
 Illustration eines Nephrons (Quelle: Kunstwerk von Holly Fischer [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)] über Wikimedia Commons)
Illustration eines Nephrons (Quelle: Kunstwerk von Holly Fischer [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)] über Wikimedia Commons) In der Literatur gibt es eine gewisse Verwirrung in Bezug auf die Nomenklatur der anfänglichen Segmente des Nephrons, zu denen die Bowman -Kapsel enthalten ist. Manchmal wird es als ein anderer Teil des Glomerulus beschrieben und bildet damit den Nierenkorpuskel, während es für andere eine Funktion als Mitglied des Glomerulus hat.
Unabhängig davon, dass die Kapsel in den anatomischen Beschreibungen Teil des Glomerulus ist, ist die Tatsache, dass beide Elemente in seiner Struktur und Funktion so enorm assoziiert sind Schiffe.
Wenn nicht, wäre die Kapsel einfach ein Behälter, in dem das in den Glomerulus filtrierte Flüssigkeit gegossen wird, aber es wäre kein Teil desselben glomerulären Filtrationsprozesses. Was nicht so ist, da sie, wie man gesehen werden wird, Teil dieses Prozesses ist, zu dem sie auf besondere Weise beiträgt.
[TOC]
Struktur und Histologie
Bowmans Kapsel ist wie eine winzige Kugel, deren Wand im Gefäßsektor invaginiert ist. In dieser Invagination wird die Kapsel durch den Haarsnack durchdrungen, der aus dem afferenten Arteriola stammt und das Blut in den Glomerulus bringt, wo auch die Eferiola, die das Blut aus dem Glomerulus nimmt, ebenfalls herauskommt.
Das entgegengesetzte Ende der Kapsel, genannt Harnpol, wird so dargestellt, als ob die Wand der Kugel ein Loch hätte, zu dem das Ende des ersten Segments, das die tubuläre Funktion selbst beginnt.
Diese Außenwand der Kapsel ist ein flaches Epithel und wird als parietales Epithel der Bowman -Kapsel bezeichnet. Änderung der Struktur beim Übergang zum Epithel des proximalen Tubulus im Harnpol und zum viszeralen Epithel im Gefäßpol.
Kann Ihnen dienen: fungiforme PapillenDas invagierte Epithel wird als viszeral bezeichnet, weil es die glomerulären Kapillaren so umhüllt. Es wird von Zellen gebildet, die als Podozyten bezeichnet werden, die sie an die Kapillaren umarmen, sie bedecken und ganz besondere Eigenschaften haben.
Die Podozyten sind in einer einzigen Schicht organisiert, wodurch Verlängerungen emittiert werden, die sich mit den Erweiterungen benachbarter Podozyten verbinden und Räume zwischen ihnen als Poren in Spalt- oder Filtrationsschlitzen lassen und Kontinuitätslösungen für den Schritt der Filterung sind.
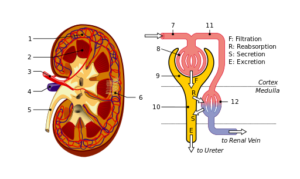 Nieren- und Nephronstruktur: 1. Nierenrinde; 2. Mark; 3. Nierenarterie; 4. Nierenvenen; 5. Harnleiter; 6. Nephronen; 7. Afferent Arteriola; 8. Glomerulus; 9. Bowman -Kapsel; 10. Tubuli und Hanle tun; elf. Peritubuläre Kapillaren (Quelle: Datei: Physiologie_Of_nephron.SVG: Madhero88File: Nierenrurtures_Piom.SVG: Piotr Michał Jaworski; Piom in Plderivative Arbeit: Daniel Sachse (Antares42) [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons)
Nieren- und Nephronstruktur: 1. Nierenrinde; 2. Mark; 3. Nierenarterie; 4. Nierenvenen; 5. Harnleiter; 6. Nephronen; 7. Afferent Arteriola; 8. Glomerulus; 9. Bowman -Kapsel; 10. Tubuli und Hanle tun; elf. Peritubuläre Kapillaren (Quelle: Datei: Physiologie_Of_nephron.SVG: Madhero88File: Nierenrurtures_Piom.SVG: Piotr Michał Jaworski; Piom in Plderivative Arbeit: Daniel Sachse (Antares42) [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons) Podozyten und Endothelzellen, die eine Basalmembran bedecken, auf der sie stützen, und auch Kontinuitätslösungen für den Durchgang von Wasser und Substanzen aufweisen. Endothelzellen sind Fenster und ermöglichen auch eine Filtration.
Diese drei Elemente: Kapillarendothel, Basalmembran und viszerales Epithel der Bowman -Kapsel bilden die Membran- oder Filtrationsbarriere zusammen.
Funktionen
Die Kapsel ist mit dem glomerulären Filtrationsprozess verbunden. Einerseits, weil es Teil der epithelialen Abdeckung von Podozyten ist, die die glomerulären Kapillaren umgeben. Es trägt auch die Synthese der Basalmembran bei, auf der dieses Epithel und das glomeruläre Kapillarendothel unterstützt werden.
Diese drei Strukturen: Kapillarendothel, Basalmembran und viszerales Epithel der Bowman -Kapsel bilden die sogenannte Membran- oder Filtrationsbarriere, und jeder von ihnen hat seine eigenen Permeabilitätsmerkmale, die zur globalen Selektivität dieser Barriere beitragen.
Darüber hinaus bestimmt das Flüssigkeitsvolumen, das in den Bowman -Raum eindringt, zusammen mit dem Grad der Steifigkeit, dem sich die externe Kapsel -Außenwand ausspricht.
Kann Ihnen dienen: Periost: Eigenschaften, Funktionen und HistologieDeterminanten der Größe der glomerulären Filtration
Eine Variable, die die Größe des glomerulären Filtrationsprozesses sammelt, ist das sogenannte glomeruläre Filtrationsvolumen (VFG). Sein durchschnittlicher Normalwert beträgt etwa 125 ml/min oder 180 l/Tag.
Die Größe dieser Variablen wird aus physikalischer Sicht durch zwei Faktoren bestimmt, nämlich den sogenannten Filtrations- oder Ultrafiltrationskoeffizienten (KF) und den effektiven Filtrationsdruck (PEFF). Das heißt: vfg = kf x peff (Gleichung 1)
Filtrationskoeffizient (KF)
Der Filtrationskoeffizient (KF) ist das Produkt der hydraulischen Leitfähigkeit (LP), das die Wasserpermeabilität einer Membran in ml/min pro Flächeneinheit und Einheit des Drucks durch die Oberfläche (a) der Filtermembran, misst. Das heißt, kf = lp x a (Gleichung 2).
Die Größe des Filtrationskoeffizienten zeigt das Volumen der Flüssigkeit an, das pro Zeiteinheit und pro Einheit eines effektiven Antriebs gefiltert wird. Obwohl es sehr schwierig ist, direkt zu messen, kann es aus Gleichung 1 erhalten werden, wobei VFG/PEFF teilt.
Der KF in den glomerulären Kapillaren beträgt 12,5 ml/min/mmHg pro c/100 g Gewebe, Wert etwa 400 -mal höher als der KF anderer Kapillarsysteme des Körpers, wo Sie etwa 0,01 ml/min/mm Hg pro 100 filtern können G Stoff. Vergleich mit glomerulärer Filtereffizienz.
Effektiver Filtrationsdruck (PEFF)
Der wirksame Filtrationsdruck stellt das Ergebnis der algebraischen Summe der verschiedenen Druckkräfte dar, die sich der Filtration befassen oder ablehnen. Es gibt einen hydrostatischen Druckgradienten (δP) und einen weiteren osmotischen Druck (onkotisch, Δп), der durch das Vorhandensein von Proteinen im Plasma bestimmt wird.
Der hydrostatische Druckgradient ist die Druckdifferenz zwischen der Innenseite der glomerulären Kapillare (PCG = 50 mm Hg) und dem Bowman -Kapselraum (PCB = 12 mm Hg). Wie zu sehen ist dieser Gradient von der Kapillare zur Kapsel und fördert die Verschiebung von Flüssigkeit in dieser Hinsicht.
Kann Ihnen dienen: appendiculares Skelett: Funktionen und KnochenDer osmotische Druckgradient bewegt die Flüssigkeit kleiner bis höher osmotischer Druck. Nur Partikel, die nicht filtern, üben diesen Effekt aus. Proteine filtern nicht. Seine пCB ist 0 und in der пcg glomerulären Kapillare ist es 20 mm Hg. Dieser Gradient bewegt Flüssigkeit aus der Kapsel in die Kapillare.
Der effektive Druck kann berechnet werden, indem PEFF = ΔP-Δп angewendet wird; = (PCG-PCB)-(пCG-пCB); = (50-12)-(20-0); = 38-20 = 18 mm Hg. Es gibt daher einen effektiven oder Nettofiltrationsdruck von etwa 18 mm Hg, der eine VFG von etwa 125 ml/min bestimmt.
Filtrationsindex (if) der im Plasma vorhandenen Substanzen
Es ist ein Indikator für die Leichtigkeit (oder Schwierigkeit), mit der eine im Plasma vorhandene Substanz die Filtrationsbarriere überqueren kann. Der Index wird erhalten, indem die Konzentration der Substanz in die Filterung (FX) zwischen seiner Konzentration im Plasma (PX) unterteilt wird, dh IFX = FX/ PX.
Der Bereich von If -Werten liegt zwischen maximal 1 für diejenigen Substanzen, die frei filtern, und 0 für diejenigen, die nichts filtern. Zwischenwerte sind für Partikel mit Zwischenschwierigkeiten. Je näher an 1 der Wert, desto besser die Filtration. Näher an 0, schwieriger zu filtern.
Einer der Faktoren, der das IF bestimmt, ist die Größe des Teilchens. Diejenigen, die einen Durchmesser von weniger als 4 nm haben, filtern frei (if = 1). Wenn die Größe wächst und sich der von Albumin nähert, wird die Fe reduziert. Partikel der Albumingröße oder größer haben 0 IFs von 0.
Ein weiterer Faktor, der dazu beiträgt, die IF zu bestimmen, die negative elektrische Belastungen auf der molekularen Oberfläche sind. Proteine haben viel negative Belastung, was ihrer Größe hinzugefügt wird, um ihre Filtrabilität zu behindern. Der Grund dafür ist, dass Poren negative Ladungen haben, die die von Proteinen abwehren.
Verweise
- Ganong WF: Nierenfunktion und Miktion, in Überprüfung der medizinischen Physiologie, 25. ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JI: Das Harnsystem, in Lehrbuch der medizinischen Physiologie , 13. ED, AC Guyton, Je Hall (Hrsg.). Philadelphia, Elsevier Inc., 2016.
- Lang F, Kurtz A: Niere, in Physiologie des Menschen -Milben Pathophysiologie, 31. ED, RF Schmidt et al. (Hrsg.). Heidelberg, Springer Medizin Verlag, 2010.
- Silbernagl S: Die FunKction der Nieren, in Physiologie, 6. ED; R Klinke et al. (Hrsg.). Stuttgart, Georg Thieme Verlag, 2010.
- Stahl Rak et al Klinche Pathophysiologie, 8. ED, W SIGENGENTHALER (Hrsg.). Stuttgart, Georg Thieme Verlag, 2001.
- « Was sind faserige Gelenke? Typen und Eigenschaften
- Baragonnosia Herkunft, Konzept, Test, verwandte Störungen »

