Zinkchromatstruktur, Eigenschaften, erhalten, verwendet, verwendet

- 1353
- 119
- Ibrahim Steuk
Er Zinkchromat o Cinc -Chromat ist eine anorganische Verbindung, die durch Zink (Zn), Chrom (CR) und Sauerstoff (O) (O) (O) gebildet wird. Es hat die Zn -Ionen2+ und Cro42-. Seine chemische Formel ist Zncro4.
Der Begriff "Chromat of Zink" dient kommerziell dazu, drei Verbindungen mit unterschiedlicher molekularer Struktur zu bezeichnen: (a) das Chromat des Zink -Zncros4, (b) das Grundchromat von Fifcro4• 4Zn (OH)2, und (c) das Grundchromat von Zink und 3Zncro Kalium4• Zn (OH)2• k2Cro4• 2H2ENTWEDER.
 Zinkchromatstruktur. Autor: Marilú Stea.
Zinkchromatstruktur. Autor: Marilú Stea. Es wird hauptsächlich in Gemälden oder Mitteln verwendet, die Korrosionsmetalle schützen. Dazu wird es mit Gemälden, Lacken und Polymeren gemischt, die dann auf der Oberfläche der Metalle gelten.
Es wird auch in dekorativen und schützenden Oberflächen verwendet, die mit anderen Chromaten und Säuren erzielt werden, die verschiedene Objekte wie Werkzeuge beschichten. Es dient auch dazu, die elektrische Leitfähigkeit von Metallteilen zu behalten.
Es wird als Katalysator bei Hydrierungsreaktionen (Zugabe von Wasserstoff) in organischen Verbindungen verwendet. Es ist Teil der Pigmente, die früher in künstlerischen Gemälden verwendet wurden.
Es ist ein Material, das Krebs erzeugt, und dies liegt daran.
[TOC]
Struktur
 Zincro -Chromat4 Es ist eine gelbe Verbindung. Autor: Marilú Stea.
Zincro -Chromat4 Es ist eine gelbe Verbindung. Autor: Marilú Stea. Das Zinkchromat ist eine ionische Verbindung, die durch das fünfzehn Kation Zn gebildet wird2+ und der Cromato -Anion42-. Letzteres wird durch Chrom mit Valencia +6 (hexavalent Chrom, CR6+) und vier Sauerstoffatome mit Oxidationszustand -2 -2.
Das Zn -Ion2+ Es hat die folgende elektronische Struktur:
1s2, 2s2 2 p6, 3s2 3p6 3d10.
Das hexavalente Chrom hat seinerseits in seinen elektronischen Orbitalen die folgende Konformation:
1s2, 2s2 2 p6, 3s2 3p6.
Beide Strukturen sind sehr stabil, wenn die Orbitale abgeschlossen sind.
Nomenklatur
- Zinkchromat
- Chromsäure -Zinksalz
- Zinkgelb (obwohl mit diesem Begriff andere Verbindungen, die Zncro enthalten4).
Eigenschaften
Körperlicher Status
Gelbe Zitronengelb kristalline Feststoff. PRISMS -verdrängte Kristalle.
Molekulargewicht
181,4 g/mol
Schmelzpunkt
316 ºC
Dichte
3,40 g/cm3
Löslichkeit
Wasser löslich in Wasser: 3,08 g/100 g H2ENTWEDER. Es wird leicht in Säuren und flüssigem Ammoniak gelöst. Unlöslich in Aceton.
Kann Ihnen dienen: IonisationskonstantepH
Nach einigen Quellen sind ihre wässrigen Lösungen sauer.
Chemische Eigenschaften
Es ist eine stark oxidierende Verbindung, sodass sie mit reduzierenden Wirkstoffen reagieren kann, die Wärme erzeugen. Unter den Substanzen, mit denen die organischen reagieren können, wie Cyanide, Ester und Tiocianaten. Sie können auch einige Metalle angreifen.
In wässriger Lösung weist das Chromation in Abhängigkeit vom pH -Wert und der Bildung verschiedener Arten verschiedene Balancen auf.
Spezies, die durch Chromat gebildet werden
Über pH 6 ist das Cromato -Ion vorhanden42- (Gelb); Zwischen pH 2 und pH 6 befinden sich das HCRO -Ion im Gleichgewicht4- und Cr Dichromat2ENTWEDER72- (Orange Rot); Bei pH weniger als 1 ist die Hauptart h h2Cro4.
Wenn das Zink (II) -Kation zu diesen wässrigen Lösungen hinzugefügt wird, fällt der Zncro aus4.
Die Balancen sind wie folgt:
HCRO4- ⇔ cro42- + H+
H2Cro4 ⇔ hcro4- + H+
Cr2ENTWEDER72- + H2Oder ⇔ 2 HCRO4-
Im Basismedium tritt das folgende auf:
Cr2ENTWEDER72- + Oh- ⇔ hcro4- + Cro42-
HCRO4- + Oh- ⇔ cro42- + H2ENTWEDER
Der Zncro4 Es reagiert nicht schnell mit Luft oder Wasser.
Erhalten
Es kann erzeugt werden, indem ein wässriges Schlamm aus Zinkoxid oder Hydroxid mit einem gelösten Chromatsalz reagiert und dann neutralisiert wird.
Industriell wird das Cronak -Prozess verwendet, in dem der Metallnebel in eine Natrium -Dichromat -Lösung eingetaucht ist (NA2Cr2ENTWEDER7) und Schwefelsäure (h)2SW4).
Es kann auch hergestellt werden, indem es aus Lösungen ausfällt, in denen gelöste Zink- und Chromatalze vorhanden sind:
K2Cro4 + ZnSO4 → Zncro4↓ + k2SW4
Anwendungen
Im Metallschutz
In der metallurgischen Industrie wird es hauptsächlich in Hintergrundmalerei.
Es wird als Pigment in Gemälden und Lack verwendet und in die Matrix eines organischen Polymers eingeführt.
Diese Art von Farben wird Rohren, Öltanks, Stahlkonstruktionen wie Brücken, elektrischen Stromübertragungstürmen und Autoteilen verabreicht, um Korrosion zu hemmen.
 Brückenstahlkonstruktionen werden vor der endgültigen Farbe mit einer Zinkchromatbasis bemalt, um sie vor Korrosion zu schützen. Autor: オギクボ マンサク. Quelle: Pixabay.
Brückenstahlkonstruktionen werden vor der endgültigen Farbe mit einer Zinkchromatbasis bemalt, um sie vor Korrosion zu schützen. Autor: オギクボ マンサク. Quelle: Pixabay. Passivierung
Es schützt auch Metallkomponenten, die mit Zink bedeckt sind, die mit alkalischen Metallchromaten bestanden wurden. Die Passivierung besteht aus dem Verlust der chemischen Reaktivität unter bestimmten Umweltbedingungen.
Kann Ihnen dienen: Elektrochemische ZellenDiese Beschichtungen dienen auch als dekorative Oberflächen und halten die elektrische Leitfähigkeit bei. Sie gelten üblicherweise für tägliche Artikel wie Werkzeuge und können durch ihre gelbe Farbe erkannt werden.
 Einige Werkzeuge sind mit Zinkchromat bedeckt. Autor: Duk. Quelle: Wikimedia Commons.
Einige Werkzeuge sind mit Zinkchromat bedeckt. Autor: Duk. Quelle: Wikimedia Commons. Wie funktioniert es
Bestimmte Ermittler fanden heraus. Auf diese Weise die Verschlechterung der antikorrosiven Farbbeschichtung.
Andere Studien zeigen, dass die antikorrosive Wirkung darauf zurückzuführen sein könnte, dass die Verbindung die Bildung von Schutzoxiden auf Metallen beschleunigt.
 Zinkchromat für einen antikorrosiven Hintergrund für den Schutz der Metalloberflächen. 水水/cc by-sa (https: // creevecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons.
Zinkchromat für einen antikorrosiven Hintergrund für den Schutz der Metalloberflächen. 水水/cc by-sa (https: // creevecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons. Reaktionen Katalyse
Diese Verbindung wurde als Katalysator in verschiedenen chemischen Reaktionen verwendet, wie z. B. Kohlenmonoxidhydrierung (CO), um Methanol (CH) zu erhalten3OH).
Die Ester können durch Hydrierung in primäre Alkohole umgewandelt werden, um die Reaktion zu beschleunigen.
Nach Ansicht einiger Forscher beruht seine katalytische Wirkung darauf4 Und es ist eher:
Zn1-xCr2-xENTWEDER4
Dies impliziert, dass es Defekte in der Struktur gibt, die die Katalyse energisch bevorzugen.
Andere Apps
Es kommt in einigen fettigen Farbstoffen vor, es dient zum Drucken, ist ein Mittel zur Oberflächenbehandlung, es wird in Böden von Böden angewendet und ein Reagenz in chemischen Labors ist.
Eingebrauchtes Gebrauch
Seit den 1940er Jahren wurde ein Zncro -Derivat verwendet4, Zink- und Kupferchromat als Blattfungizid für Kartoffelpflanzen.
 Papstpflanzen. Autor: Dirk (Beeki®) Schumacher. Quelle: Pixabay.
Papstpflanzen. Autor: Dirk (Beeki®) Schumacher. Quelle: Pixabay. Diese Verwendung wurde bereits durch die Toxizität und die schädlichen Wirkungen der Verbindung aufgegeben.
In künstlerischen Gemälden des neunzehnten Jahrhunderts wurde das Vorhandensein von komplexem Zinkchromatsalz gefunden, der 4zncro4• k2Oder • 3h2O (Zinkchromat und hydratisiertes Kalium), ein gelbes Pigment namens Zitronengelb.
Kann Ihnen dienen: Lithiumchlorid (LICL): Eigenschaften, Risiken und VerwendungRisiken
Obwohl es kein Kraftstoff ist, emittiert es beim Erhitzen giftige Gase. Kann explodieren, wenn Sie mit reduzierenden Mitteln oder organischen Materialien in Kontakt kommen.
Staub gereizt Augen und Haut, die allergische Reaktion erzeugen. Seine Inhalation verursacht Nasen- und Rachenreizungen. Es betrifft die Lunge, verursacht Verkürzung, Bronchitis, Lungenentzündung und Asthma.
Seine Einnahme wirkt sich auf den Verdauungstrakt, die Leber, die Nieren und den Zentralnervensystem aus, erzeugt einen Kreislaufkollaps und schädigt das Immunsystem.
Krebsgenerator
Es handelt sich um ein bestätigtes Karzinogen, erhöht das Risiko für Lungenkrebs und die Nasenhöhle. Es ist toxisch für Zellen (zytotoxisch) und schädigt auch Chromosomen (genotoxisch).
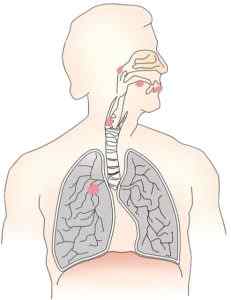 Zinkchromat produziert Lungenkrebs und Atemwege. Autor: OpenClipart-Vektoren. Quelle: Pixabay.
Zinkchromat produziert Lungenkrebs und Atemwege. Autor: OpenClipart-Vektoren. Quelle: Pixabay. Es wurde festgestellt, dass die Toxizität und Karzinogenität dieser Verbindung hauptsächlich durch die Wirkung von Chrom bei Oxidation +6 verursacht wird. Das Vorhandensein von Cinc verleiht dem Produkt jedoch eine Unlöslichkeit, und dies beeinflusst auch den Schaden, den es verursacht.
Auswirkungen auf die Umwelt
Es ist sehr giftig für Tiere und für Wasserleben, was schädliche Wirkungen verursacht, die im Laufe der Zeit dauern. Dieser Chemiker kann in der gesamten Nahrungskette bioakumuliert werden.
Aus all diesen Gründen werden die Prozesse, die Chromate (hexavalentes Chrom) beinhalten, von Weltgesundheitsorganisationen reguliert und durch alternative Techniken ohne dieses Ion ersetzt.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Zinkchromat. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Blei, d.R. (Herausgeber) (2003). CRC -Handbuch für Chemie und Physik. 85th CRC Press.
- Xie, h. et al. (2009). Zinkchromat -Induts -Chromosomeninstabilität und DNA -Dobel -Stradbrüche in menschlichen Lun -Zellen. Toxicol Appl Pharmacol 2009 Februar; 234 (3): 293-299. NCBI erholte sich.NLM.NIH.Regierung.
- Jackson, r.ZU. et al. (1991). Die katalytische Aktivität und Defektstruktur des Zinkchromats. Katallett 8, 385-389 (1991). Link wiederhergestellt.Springer.com.
- Yahalom, J. (2001). Korrosionsschutzmethoden. In Enzyklopädie von Materialien: Wissenschaft und Technologie. Von Scientedirect erholt.com.
- Fremder-Johannnen, m. (1988). Die antimikrobielle Wirkung von Pigmenten in Korrosionsschutzfarben. In Houchton d.R., Eggins, h.ENTWEDER.W. (Hrsg.) Biodeterioration 7. Link wiederhergestellt.Springer.com.
- Barrett, a.G.M. (1991). Die Ermäßigung. Beim Verständnis der organischen Synthese. Von Scientedirect erholt.com.
- Donnerstag, h.W. et al. (1948). Chromate als Kartoffel -Fungizide. American Potato Journal 25, 406-409 (1948). Link wiederhergestellt.Springer.com.
- Lynch, r.F. (2001). Zink: Legierung, thermochemische Verarbeitung, Eigenschaften und Anwendungen. In Enzyklopädie von Materialien: Wissenschaft und Technologie. Von Scientedirect erholt.com.
- Ramesh Kumar, a.V. und Nigam, r.K. (1998). MOSSBAUER -Spektroskopiestudie von Korrosionsprodukten unter der ersten Beschichtung, die antikorrosive Pigmente enthält. J Radioanal Nucl Chem 227, 3-7 (1998). Link wiederhergestellt.Springer.com.
- Otero, v. et al. (2017). Barium, Zink und Stontium im späten 19. bis frühes Ölgemälde des 20. Jahrhunderts. Herit Sci 5, 46 (2017). Von HeritagesCiencejournal erholt.Springeropen.com.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Wikipedia (2020). Zinkchromat. Abgerufen von.Wikipedia.Org.
- Wikipedia (2020). Chromatkonvertierungsbeschichtung. Abgerufen von.Wikipedia.Org.
- « Pazifischer Feuergürtel, Eigenschaften, Hauptvulkane
- Zinkchlorid (ZNCL2) -Struktur, Eigenschaften, erhalten, verwendet, verwendet »

