Chrom (Cr)

- 1058
- 2
- Rieke Scheer
 Chrom ist ein sehr reaktives Metall. Wikimedia Commons
Chrom ist ein sehr reaktives Metall. Wikimedia Commons Was ist Chrom?
Er Chrom (CR) ist ein chemisches Element der Gruppe 6 (VIB) der Periodenzüchtertabelle. Jährlich werden Tonnen dieses Metalls durch Extraktion von Chromit- oder Magnesiummineral (FECR (FECR) erzeugt2ENTWEDER4, Mgcr2ENTWEDER4), die mit Kohle reduziert werden, um Metall zu erhalten. Es ist sehr reaktiv und nur unter sehr reduzierenden Bedingungen in seiner reinen Form.
Seine Mineralien und Oxide sowie ein winziger metallischer Kupferabschnitt machen dieses Element die Zahl 22 der am häufigsten vorkommenden Erdkortex.
Die Chromchemie ist sehr vielfältig, da sie Verbindungen mit fast der gesamten Periodenzeittabelle bilden kann. Jede seiner Verbindungen zeigt Farben, die von der Oxidationszahl abhängen, sowie die Arten, die damit interagieren.
Außerdem bilden Sie Verbindungen zu Kohlenstoff und intervenieren in einer großen Anzahl von organomethalischen Verbindungen.
Chromeigenschaften und Eigenschaften
Chrom ist ein Silbermetall in seiner reinen Form mit Atomzahl 24 und einem Molekulargewicht von ungefähr 52 g/mol (52CR, sein stabilstes Isotop).
Angesichts der starken Metallverbindungen präsentiert es Fusionspunkte (1907 ºC) und Kochen (2671 ºC) hoch. Auch seine kristalline Struktur macht es zu einem sehr dichten Metall (7.19 g/ml).
Es reagiert nicht mit Wasser, um Hydroxide zu bilden, sondern mit Säuren. Es oxidiert mit dem Sauerstoff der Luft im Allgemeinen Chromoxid, das ein weit verbreitetes grünes Pigment ist.
Diese Oxidschichten erzeugen das, was bekannt ist Passivierung, Schutz des Metalls vor nachfolgenden Korrosionen, da Sauerstoff nicht in den Sinus Metall eindringen kann.
Die elektronische Konfiguration beträgt [AR] 4s13d5, Mit allen fehlenden Elektronen und daher zeigt es paramagnetische Eigenschaften. Die Paarung elektronischer Spins kann jedoch auftreten, wenn Metall niedrigen Temperaturen ausgesetzt ist und andere Eigenschaften wie Antiferromagnetismus erlangt.
Kann Ihnen dienen: FeuerfestmaterialienChemische Chromstruktur
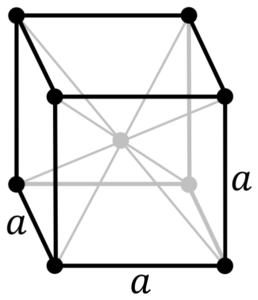 Chrommetallstruktur. Quelle: durch Original -PNGs von Daniel Mayer, Drbob, Wikimedia Commons
Chrommetallstruktur. Quelle: durch Original -PNGs von Daniel Mayer, Drbob, Wikimedia Commons Was ist die Struktur von Chrommetall? In seiner reinen Form nimmt Chrom eine kubische kristalline Struktur an, die auf den Körper zentriert ist (CC oder BCC). Dies bedeutet, dass sich das Chromatom in der Mitte eines Würfels befindet, dessen Kanten von anderen Chromen besetzt sind (wie im überlegenen Bild).
Diese Struktur ist verantwortlich für Chrom mit hohen Schmelz- und Siedepunkten sowie große Härte. Kupferatome überlappen ihre S- und D -Orbitale, um die Fahrbänder gemäß der Bandtheorie zu bilden.
Somit sind beide Bänder in zwei Hälften voll, weil ihre elektronische Konfiguration [AR] 4s beträgt13d5, Und als Orbital können zwei Elektronen und die Orbitale von zehn untergebracht werden. Dann wird nur die Hälfte der Bänder, die durch ihre Überlappungen gebildet werden, von Elektronen besetzt.
Mit diesen beiden Perspektiven -die kristalline Struktur und die metallische Verbindung -Viele der physikalischen Eigenschaften dieses Metalls können theoretisch erklärt werden. Weder erklärt, warum Chrom mehrere Zustände oder Oxidationszahlen haben kann.
Dafür ein tiefes Verständnis der Stabilität des Atoms in Bezug auf elektronische Spins.
Chromoxidationszahl
Weil die chrom elektronische Konfiguration [AR] 4S ist13d5 Sie können bis zu ein oder zwei Elektronen (Cr) gewinnen1- und Cr2-) oder sie verlieren, um unterschiedliche Oxidationszahlen zu erwerben.
Wenn also das Chrom ein Elektron verliert, wäre es als [ar] 4s03d5; Wenn Sie drei verlieren, [ar] 4s03d3; Und wenn Sie sie alle verlieren, [AR] oder was gleich ist, wäre es für Argon isolektronisch.
Kann Ihnen dienen: Siedepunkt: Konzept, Berechnung und BeispieleChrom verliert oder gewinnen keine Elektronen aufgrund bloßer Laune.
Das Chrom hat die folgenden Oxidationszahlen: -2, -1, 0, +1, +2, +3, +4, +5 und +6. Von ihnen die +3, Cr3+, Es ist das stabilste und daher die vorherrschende von allen; gefolgt von +6, cr6+.
Chrome verwendet
Als Farbstoff oder Pigment
Das Chrom hat eine breite Palette von Anwendungen, vom Farbstoff für verschiedene Arten von Stoffen bis hin zu dem Beschützer, der die Metallstücke in dem so genannten Chromed bedeckt, das mit reinem Metall oder CR -Verbindungen (III) oder Cr durchgeführt werden kann (Vi).
Cromic Fluoruro (CRF3) zum Beispiel wird es als Farbstoff für Wolltücher verwendet; Cromic -Sulfat (Cr2(SW4)3), es ist dazu bestimmt, Emaille, Keramik, Gemälde, Tinten, Lacken und auch Chromarmetalle zu färben. und Chromoxid (CR2ENTWEDER3) Finden Sie auch Gebrauch, wo seine attraktive grüne Farbe erforderlich ist.
Daher kann jedes Chrommineral mit intensiven Farben dazu bestimmt sein, eine Struktur zu färben, aber danach ist die Tatsache, ob diese Verbindungen gefährlich sind oder nicht für die Umwelt oder für die Gesundheit von Einzelpersonen.
Tatsächlich werden seine giftigen Eigenschaften verwendet, um Holz und andere Insektenangriffsflächen zu erhalten.
In verchromt oder metallurgisch
Ebenso werden kleine Mengen Chrom zu Stahl hinzugefügt, um es angesichts der Oxidation zu stärken und seine Helligkeit zu verbessern. Dies liegt daran, dass es in der Lage ist, graue Carbide zu bilden (Cr3C2) Sehr resistent, wenn Sie mit dem Sauerstoff der Luft reagieren.
Kann Ihnen dienen: Calciumhydroxid (CA (OH) 2): Struktur, Eigenschaften, erhalten, verwendet, verwendetDa Chrom bis helle Oberflächen polieren kann, präsentiert Chrom dann Silberdesigns und Farben als billiger.
Ernährung
Einige Debatten, wenn Chrom als wesentliches Element angesehen werden kann, das heißt in der täglichen Ernährung unverzichtbar. Es ist in einigen Lebensmitteln in sehr kleinen Konzentrationen wie grünen Blättern und Tomaten vorhanden.
Es gibt auch Proteinpräparate, die die Insulinaktivität regulieren und das Muskelwachstum bevorzugen, wie dies bei Chrom -Polynikotinato der Fall ist.
Wo ist das Chrom??
Chrom findet sich in einer Vielzahl von Mineralien und Edelsteinen wie Rubinen und Smaragden. Das Hauptmineral, aus dem das Chrom extrahiert wird, ist der Chromit (MCR2ENTWEDER4), Wobei m jedes andere Metall sein kann, mit dem Chromoxid assoziiert ist. Diese Minen sind in Südafrika, in Indien, in der Türkei, Finnland, Brasilien und anderen Ländern im Überfluss vorhanden.
Jede Quelle hat eine oder mehrere Chromitvarianten. Auf diese Weise für jeden M (Glaube, Mg, Mn, Zn usw.) Es entsteht ein anderes Chrommineral.
Um das Metall zu extrahieren, ist es notwendig. Dies geschieht mit Kohlenstoff oder Aluminium:
Fecr2ENTWEDER4 + 4C => Fe + 2Cr + 4CO
Ebenso wird die Chromita gefunden (pbcro4).
Normalerweise in einem Mineral, in dem die Ionen -Cr CR3+ kann al ersetzen3+, Beide mit leicht ähnlichen ionischen Radios sind eine Verunreinigung, die zu einer weiteren natürlichen Quelle dieses erstaunlichen, aber schädlichen Metalls führt.
Verweise
- Tenebaum e. Chrom. Entnommen aus: Chemie.Pomona.Edu
- Chemistry Librettexts. Chemie des Chroms. Genommen von: Chem.Librettexts.Org
- Chrom. Ausgenommen von: Chemistry Explaed.com

