Was sind die Gewichtsgesetze der Chemie?? (Beispiele)

- 900
- 176
- Joy Hort
Der Weareral -Gesetze der Chemie Sie sind diejenigen, die gezeigt haben, dass die Massen der Substanzen, die reagiert werden, dies nicht willkürlich oder zufällig tun; aber einen ständigen mathematischen Anteil an ganzen Zahlen oder Untermultipeln von ihnen beibehalten, in denen die Atome der Elemente nicht erzeugt oder zerstört werden.
In vergangenen Zeiten erforderte die Festlegung dieser Gesetze außergewöhnliche Argumentationsanstrengungen; Denn obwohl es jetzt zu offensichtlich erscheint, waren vor den atomaren oder molekularen Massen der Elemente oder Verbindungen nicht einmal bekannt.
 Quelle: Jeff Keyzer von Austin, TX, USA [CC BY-SA 2.0 (https: // creativecommons.Org/lizenzen/by-sa/2.0)]]
Quelle: Jeff Keyzer von Austin, TX, USA [CC BY-SA 2.0 (https: // creativecommons.Org/lizenzen/by-sa/2.0)]] Da es nicht bekannt war. So dass rudimentäre analytische Skalen (überlegenes Bild) untrennbare Gefährten während der Hunderte von Experimenten waren, die für die Siedlung der Gewichtungsgesetze erforderlich waren.
Aus diesem Grund stießen sie, wenn diese Gesetze der Chemie untersucht werden, in jedem Moment auf Massenmessungen. Dank dessen wurde festgestellt Rein Sie bilden sich immer mit dem gleichen Massenanteil ihrer Bestandteilelemente.
[TOC]
Gesetz der Erhaltung der Masse
Dieses Gesetz besagt, dass die Gesamtmasse der Reagenzien in einer chemischen Reaktion der Gesamtmasse der Produkte entspricht. Solange das betrachtete System geschlossen ist und es keinen Massen- und Energieaustausch mit seiner Umgebung gibt.
In einer chemischen Reaktion verschwinden Substanzen nicht, werden jedoch in andere Substanzen gleicher Masse umgewandelt. Von dort aus dem berühmten Satz: "Nichts wird geschaffen, nichts wird zerstört, alles wird verwandelt".
Historisch gesehen wurde das Gesetz der Massenschutz in einer chemischen Reaktion erstmals 1756 von Mikhail Lomonsov vorgeschlagen, der in seinem Tagebuch die Ergebnisse seiner Experimente zeigte.
Anschließend präsentierte Antoine Levosier, ein französischer Chemiker, die Ergebnisse seiner Experimente, die dies ermöglichten; Was, einige nennen es auch Lavoisores Gesetz.
-Lavoisier -Experimente
In der Zeit von Lavoissier (1743-1794) gab es die Theorie von Flogisto, nach der die Körper die Fähigkeit hatten, sich zu entflammen oder zu verbrennen. Lavoisier -Experimente durften diese Theorie verwerfen.
Lavoissier führte zahlreiche Metallverbrennungsexperimente durch. Er wog die Materialien vor und nach seiner Verbrennung in einem geschlossenen Behälter sorgfältig ab und stellte fest, dass es eine offensichtliche Gewichtszunahme gab.
Lavoiser, basierend auf der Kenntnis der Rolle des Sauerstoffs in der Verbrennung. Das Konzept der Metalloxides wurde geboren.
Daher blieb die Summe der Massen der Metalle, die Verbrennung und Sauerstoff ausgesetzt waren. Diese Schlussfolgerung ermöglichte die Einrichtung des Massenschutzgesetzes.
-Ausgleich von Gleichungen
Das Massenschutzgesetz hat die Notwendigkeit festgestellt, chemische Gleichungen auszugleichen und zu garantieren, dass die Anzahl aller Elemente, die an einer chemischen Reaktion beteiligt sind, sowie Reagenzien oder Produkte genau gleich sind.
Dies ist eine wesentliche Voraussetzung für die Genauigkeit der stöchiometrischen Berechnungen, die durchgeführt werden.
-Berechnungen
Maulwürfe Wasser
Wie viele Wassermolen können während der Verbrennung von 5 Mol Methan in einem überschüssigen Sauerstoff auftreten? Zeigt auch, dass das Gesetz der Erhaltung der Materie erfüllt ist.
CH4 + 2 o2 => Co2 + 2 h2ENTWEDER
Wenn Sie die ausgewogene Gleichung der Reaktion beobachten, wird der Schluss gezogen, dass 1 Mol Methan 2 Mol Wasser produziert.
Das Problem kann direkt mit einem einfachen Ansatz gelöst werden4:
Mol aus Wasser = 5 Mol von Cho4· (2 Mol von H2O / 1 Mol Cho4)
= 10
Was wäre gleich 180 g H2ENTWEDER. Es wurde ebenfalls 5 mol oder 220 g CO gebildet2, das entspricht einer Gesamtmasse von 400 g Produkte.
Somit für das Gesetz der Erhaltung des Subjekts auf 400 g Reagenzien; nicht mehr und nicht weniger. Von diesen 400 g entsprechen 80 g den 5 Mol von Cho4 (Multiplizieren Sie mit seiner Molekülmasse von 16 g/mol) und 320 g bei 10 Mol von O2 (Ähnlich aufgrund seiner molekularen Masse von 32 g/mol).
Verbrennung eines Magnesiumbandes
Ein 1,50 g Magnesiumband in einem geschlossenen Behälter mit 0,80 g Sauerstoff verbrannt. Nach der Verbrennung befanden sich 0,25 g Sauerstoff im Behälter. a) Welche Sauerstoffmasse reagierte? b) Wie viel Magnesiumoxid wurde gebildet?
Kann Ihnen dienen: Hypotonische Lösung: Komponenten, Vorbereitung, BeispieleDie reagierte Sauerstoffmasse wird durch einen einfachen Unterschied erhalten.
Sauerstoffmasse verbraucht = (anfängliche Masse - Restmasse) Sauerstoff
= 0,80 g - 0,25 g
= 0,55 g oder2 (Zu)
Nach dem Massenschutzgesetz,
Magnesiumoxidmasse = Magnesiummasse +Sauerstoffmasse
= 1,50 g + 0,55 g
= 2,05 g mgo (b)
Gesetz der eindeutigen Ausmaße
Joseph Louis Proust (1754-1826), französischer Chemiker, erkannte, dass die chemischen Elemente in einer chemischen Reaktion immer in festen Massenproportionen reagieren, um eine Verbindung zu bilden rein Spezifisch; Daher ist seine Zusammensetzung unabhängig von der Quelle oder dem Ursprung konstant oder wie sie synthetisiert wird.
Proust stellte 1799 das Gesetz der definierten Anteile an, in dem es heißt: "Wenn zwei oder mehr Elemente zu einer Verbindung kombiniert werden, tun sie dies in einer festen Massenbeziehung". Diese Beziehung ist also fix.
Dieses Gesetz ist auch als Gesetz der ständigen Zusammensetzung bekannt, in dem: "Jede chemische Verbindung in Reinheit enthält immer die gleichen Elemente in einem konstanten Massenanteil".
-Illustration des Gesetzes
Eisen (Glaube) reagiert mit Schwefel (s), um Eisensulfid (FES) zu bilden, drei Situationen können angegeben werden (1, 2 und 3):
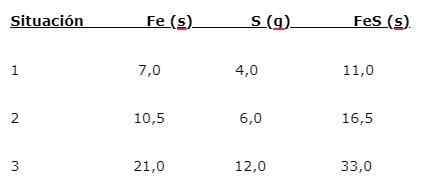
Um den Anteil zu finden, in dem die Elemente kombiniert werden, wird die Hauptmasse (Glaube) durch die Nebenmasse (en) geteilt. Die Berechnung ergibt einen Anteil von 1,75: 1. Dieser Wert wird unter den drei gegebenen Bedingungen (1, 2 und 3) wiederholt, wobei der gleiche Anteil erhalten wird, obwohl verschiedene Massen verwendet werden.
Das heißt, dass 1,75 g Glauben mit 1,0 g S kombiniert werden, um 2,75 g Fes zu ergeben.
-Anwendungen
Durch die Anwendung dieses Gesetzes können Sie genau die Massen der Elemente kennen, die kombiniert werden müssen, um eine gewünschte Masse einer Verbindung zu erhalten.
Auf diese Weise können Informationen über die übrig gebliebene Masse eines der an einer chemischen Reaktion beteiligten Elemente erhalten werden, oder wenn in der Reaktion ein einschränkendes Reagenz vorhanden ist.
Darüber hinaus gilt es, die zehnmale Zusammensetzung einer Verbindung zu kennen, und basierend auf letzterem kann die Formel einer Verbindung hergestellt werden.
Zitsimale Zusammensetzung einer Verbindung
Kohlendioxid (CO2) wird in der folgenden Reaktion gebildet:
C +o2 => Co2
12 g Kohlenstoff 32 g Sauerstoff werden kombiniert, um 44 g Kohlendioxid zu ergeben.
Der Kohlenstoffprozentsatz ist also gleich
Kohlenstoffanteil = (12 g / 44 g) · 100 %
= 27,3 %
Sauerstoffanteil = (32 g / 44 g) · 100 %
Sauerstoffanteil = 72,7 %
Unter Verwendung der Aussage des Gesetzes der ständigen Zusammensetzung kann festgestellt werden.
-Berechnungen
Schwefeltrioxid
Durch Reagieren in verschiedenen Behältern 4 g und 6 g Schwefel (s) mit Sauerstoff (O) wurden sie jeweils 10 g und 15 g Schwefeltrioxid erhalten (SO3).
Warum waren solche Mengen an Schwefeltrioxid und nicht anderen?
Berechnen Sie auch die Schwefelmenge.
Teil A)
Im ersten Behälter werden 4 g Sauerstoff gemischt, um 10 g Trioxid zu erhalten. Wenn das Gesetz zur Erhaltung des Massenschutzes angewendet wird, können wir die Sauerstoffmasse löschen, die mit Schwefel kombiniert wurde.
Sauerstoffmasse = 10 g Sauerstofftrioxid - 4 g Schwefel.
= 6 g
In Behälter 2 6 g Schwefel werden mit x g Sauerstoff gemischt, um 15 Schwefeltrioxid zu erhalten.
Sauerstoffmasse = 15 g Schwefeltrioxid - 6 g Schwefel
= 9 g
Die Proportionen o/s für jeden Container werden dann berechnet:
Anteil o / s in Situation 1 = 6 g o / 4 g s
= 1,5 / 1
Anteil o / s in Situation 2 = 9 g o / 6 g s
= 1,5 / 1
Dies stimmt mit dem überein, was im Gesetz der definierten Proportionen angesprochen wird, was darauf hinweist.
Daher sind die erhaltenen Werte korrekt und diejenigen, die der Anwendung des Gesetzes entsprechen.
Teil b)
Im vorherigen Abschnitt wurde ein Wert von 1,5 / 1 für den Anteil o / s berechnet.
Kann Ihnen dienen: Zustände der Aggregation der Materieg Schwefel = 36 Sauerstoff · (1 g Schwefel / 1,5 g Sauerstoff)
= 24 g
g Schwefeltrioxid = 36 g Sauerstoff + 24 g Schwefel
= 60 g
Chlor und Magnesium
Chlor und Magnesium sind in einem Anteil von 2,95 g Chlor für jeden g Magnesium kombiniert. a) Bestimmen Sie die Massen von Chlor und Magnesium, die erforderlich sind, um 25 g Magnesiumchlorid zu erhalten. b) Was ist die prozentuale Zusammensetzung von Magnesiumchlorid?
Teil A)
Basierend auf dem Wert von 2,95 für das CL -Verhältnis: Mg kann der folgende Ansatz durchgeführt werden:
2,95 g Cl +1 g Mg => 3,95 g Mgcl2
Dann:
g von cl = 25 g MGCL2 · (2,95 g CL / 3,95 g MGCL2)
= 18.67
G Mg = 25 g Mgcl2 · (1 g mg / 3,95 g mgcl2)
= 6,33
Dann werden 18,67 g Chlor mit 6,33 g Magnesium kombiniert, um 25 g Magnesiumchlorid zu produzieren.
Teil b)
Die molekulare Masse von Magnesiumchlorid, MGCL wird zuerst berechnet2:
MGCL -Molekulargewicht2 = 24,3 g/mol + (2 · 35,5 g/mol)
= 95,3 g/mol
Magnesiumanteil = 24,3 g / 95,3 g) x 100 %
= 25,5 %
Chloranteil = (71 g / 95,3 g) x 100 %
= 74,5 %
Gesetz von mehreren Ausmaßen oder dem Gesetz von Dalton
Das Gesetz wurde 1803 vom französischen Chemiker und Meteorologen John Dalton angegeben, basierend auf seinen Beobachtungen über die Reaktionen von atmosphärischen Gasen.
Das Gesetz wurde wie folgt angegeben: "Wenn Elemente kombiniert werden, um mehr als eine Verbindung zu ergeben, verbindet eine variable Masse einer von ihnen eine feste Masse des anderen und die erste hat eine Beziehung von Kanonen und undeutlichen Zahlen".
Außerdem: "Wenn zwei Elemente kombiniert werden, um unterschiedliche Verbindungen zu verursachen, die bei einer festen Menge von ihnen eine feste Menge des anderen Elements, die mit dieser festen Menge kombiniert sind, um die Verbindungen zu erzeugen, sind in Bezug auf einfache ganze Zahlen kombiniert.".
John Dalton machte die erste moderne Beschreibung des Atoms als Bestandteil der chemischen Elemente, als er darauf hinwies, dass die Elemente durch unteilbare Partikel gebildet werden.
Darüber hinaus postulierte er, dass die Verbindungen gebildet werden, wenn sich Atome verschiedener Elemente in Proportionen einfacher Zahlen miteinander verbinden.
Dalton absolvierte Prousts Forschungsarbeiten. Er wies auf das Vorhandensein von zwei Zinnoxiden mit 88,1% und 78,7% Zinn mit den entsprechenden Prozentsätzen des Sauerstoffs von 11,9% bzw. 21,3% hin.
-Berechnungen
Wasser- und Wasserstoffperoxid
Zeigen Sie, dass Wasserverbindungen, h2Oder und Wasserstoffperoxid, h2ENTWEDER2, Sie entsprechen dem Gesetz mehrerer Ausmaße.
Atomgewichte der Elemente: H = 1 g/mol und Sauerstoff = 16 g/mol.
Molekulare Pesos der Verbindungen: H2O = 18 g/mol und h2ENTWEDER2 = 34 g/mol.
Wasserstoff ist das Element mit einer festen Menge in h2Oder und h2ENTWEDER2, Die Proportionen zwischen O und H werden also in beiden Verbindungen festgelegt.
O/H -Verhältnis in H2O = (16 g/mol)/(2 g/mol)
= 8/1
O/H -Verhältnis in H2ENTWEDER2 = (32 g/mol)/(2 g/mol)
= 16/1
Beziehung zwischen beiden Proportionen = (16/1)/(8/1)
= 2
Dann beträgt das Verhältnis des OR/H zwischen Wasserstoffperoxid und Wasser 2, eine Ganzzahl und einfache Zahl. Es wird nachgewiesen.
Stickoxide
Welche Sauerstoffmasse wird mit 3,0 g Stickstoff in a) Stickoxid kombiniert, no und b) Stickstoffdioxid, NO2. Zeigen, dass nein und nein2 Sie entsprechen dem Gesetz mehrerer Ausmaße.
Stickstoffmasse = 3 g
Atomgewichte: Stickstoff, 14 g/mol und Sauerstoff, 16 g/mol.
Berechnungen
Im Nr. Wird ein Atom von N mit 1 Atom von O kombiniert, so dass die Sauerstoffmasse, die mit 3 g Stickstoff kombiniert wird, durch den folgenden Ansatz berechnet werden kann:
G von o = g Stickstoff · (PA. O / pa. N)
= 3 g · (16 g/mol/14 g/mol)
= 3,43 g oder
In der Nr2, Ein Atom von N wird mit 2 Atomen von O kombiniert, sodass die kombinierte Masse des Sauerstoffs ist:
G Sauerstoff = 32 g/mol/14 g/mol)
= 6,86 g oder
Anteil O/ N bei Nr. = 3,43 g o/ 3 g n
= 1.143
Anteil oder/n in nein2 = 6,86 g o / 3 g n
= 2,282
Wert der Beziehung zwischen Proportionen o / n = 2.282 / 1.143
= 2
Dann beträgt der Wert der Beziehung zwischen den Proportionen oder/n 2, eine ganze Zahl und eine einfache Zahl. Daher wird das Gesetz mehrerer Ausmaße erfüllt.
Gesetz der gegenseitigen Ausmaße
Dieses von Richter und Carl f formulierte Gesetz. Wenzel getrennt.
Kann Ihnen dienen: Natrium: Geschichte, Struktur, Eigenschaften, Risiken und VerwendungWenn Sie beispielsweise die beiden Verbindungen AB und CB haben, wird beobachtet, dass das gemeinsame Element B ist.
Richter-Wenzels Gesetz oder gegenseitige Ausmaße sagt, dass Sie die Masse berechnen können, die es benötigt, um mit einer C-Masse zu reagieren bilden ac.
Und das Ergebnis ist, dass der Anteil zu: C oder A/C ein Mehrfach- oder Submultiple von A/B oder C/B sein muss. Dieses Gesetz ist jedoch nicht immer erfüllt, insbesondere wenn die Elemente mehrere Oxidationszustände enthalten.
Von allen Gewichtsgesetzen ist dies vielleicht das "abstraktste" oder komplizierte Gesetz. Wenn jedoch aus mathematischer Sicht analysiert wird, wird er nur aus Umwandlungs- und Stornierungsfaktoren gesehen.
-Beispiele
Methan
Wenn bekannt ist, dass 12 g Kohlenstoff mit 32 g Sauerstoff zur Bildung von Kohlendioxid reagiert; und dass 2 g Wasserstoff mit 16 g Sauerstoff zur Bildung von Wasser reagiert, dann können die Massenanteile c/o und h/oder für den CO geschätzt werden2 und h2Oder jeweils.
Berechnung von C/O und H/oder Sie haben:
C / o = 12 g c / 32g oder
= 3/8
H / o = 2g h / 16g oder
= 1/8
Sauerstoff ist das gemeinsame Element, und es wird erwünscht zu wissen, wie viel Kohlenstoff mit Wasserstoff auf Methan reagiert. Das heißt, Sie möchten C/H (oder H/C) berechnen. Anschließend ist es notwendig, eine Aufteilung der vorherigen Proportionen aufzunehmen, um zu demonstrieren, ob die Gegenseitigkeit erfüllt ist oder nicht:
C/h = (c/o)/(h/o)
Beachten Sie, dass das Betriebssystem auf diese Weise storniert wird und C/H bleibt:
C/H = (3/8)/(1/8)
= 3
Und 3 ist ein 3/8 Multiple (3/8 x 8). Dies bedeutet, dass 3 g C mit 1 g H reagiert, um Methan zu ergeben. Aber um es mit dem CO vergleichen zu können2, Es ist C/H mit 4 multipliziert, was gleich 12 entspricht; Dies ergibt 12 g C, die mit 4 g H reagieren, um Methan zu bilden, was ebenfalls wahr ist.
Magnesiumsulfid
Wenn bekannt ist, dass 24 g Magnesium mit 2 g Wasserstoff zur Bildung von Magnesiumhydrid reagiert; Und zusätzlich reagiert 32 g Schwefel mit 2 g Wasserstoff zu Wasserstoffsulfid, das gemeinsam.
Anschließend haben Sie Mg/H und H/S separat: Sie haben:
Mg / h = 24 g mg / 2g h
= 12
H / s = 2g H / 32g s
= 1/16
Es ist jedoch bequem, S/H zu verwenden, um H abzubrechen. Daher ist S/H gleich 16. Damit berechnen wir Mg/s:
Mg/s = (mg/h)/(s/h)
= (12/16)
= 3/4
Und 3/4 ist ein Untermultiple von 12 (3/4 x 16). Der mg/s -Anteil zeigt an, dass 3 g Mg mit 4 g Schwefel reagiert, um Magnesiumsulfid zu bilden. Sie müssen jedoch MG/S mit 8 multiplizieren, um es mit Mg/H vergleichen zu können. Somit reagiert 24 g Mg mit 32 g Schwefel, um diesen metallischen Sulfid zu ergeben.
Aluminiumchlorid
Es ist bekannt, dass 35,5 g CL mit 1 g H reagieren, um HCl zu bilden. Auch 27 g reagiert mit 3 g H, um ALH zu bilden3. Berechnen Sie den Anteil von Aluminiumchlorid und sagen Sie, wenn eine solche Verbindung Richter-Wenzels Gesetz gehorcht.
Auch hier werden Cl/H und AT/H getrennt berechnet:
Cl / h = 35,5 g cl / 1g h
= 35,5
AT/ H = 27G AT/ 3G H
= 9
Jetzt wird es an/cl berechnet:
At/cl = (al/h)/(cl/h)
= 9/35.5
≈ 0,250 oder 1/4 (es ist tatsächlich 0,253)
Das heißt, 0,250 g reagiert mit 1 g CL, um das entsprechende Salz zu bilden. Aber auch hier muss es mit einer Zahl mit Al/H (für den Komfort) mit/Cel multipliziert werden.
Ungünstigkeiten in der Berechnung
Es wird dann AT/CL mit 108 (0,27/250) multipliziert, wobei 27 g mit 108 g CL reagiert. Dies geschieht nicht genau so. Wenn wir zum Beispiel den Wert von 0,253 mit Al/Cl nehmen und ihn mit 106,7 (27/0,253) multiplizieren, reagiert 27 g Al mit 106,7 g Cl; Was, es nähert sich mehr auf die Realität (Alcl3, mit einer PA von 35,5 g/mol für den CL).
Hier wird beobachtet.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Blumen, j. Chemie (2002). Santillana Editorial.
- Joaquín San Frutos Fernández. (S.F.). Das Gewicht und die volumetrischen Gesetze. Erholt von: Encina.Pntic.Mec.Ist
- TOPPR. (S.F.). Gesetze der chemischen Kombination. Erholt von: topppr.com
- Brillant. (2019). Gesetze der chemischen Kombination. Erholt von: Brillant.Org
- Chemistry Librettexts. (15. Juli 2015). Grundlegende chemische Gesetze. Erholt von: Chem.Librettexts.Org
- Helmestine, Anne Marie, ph.D. (18. Januar 2019). Gesetz der Erhaltung der Masse. Erholt von: thoughtco.com
- « Eroberung der kolumbianischen Entdeckung, Stadien, Konsequenzen
- 9 Arbeitsergebnisse der Karriere als Geschäftsverwaltung »

