Heizkurve Was ist, wie es tut, Beispiele

- 4404
- 975
- Said Ganzmann
A Heizkurve Es ist die grafische Darstellung, wie die Temperatur einer Probe in Abhängigkeit von der Zeit variiert, den konstanten Druck beibehalten und gleichmäßig Wärme hinzufügen, dh in einer konstanten Geschwindigkeit.
Um ein solches Graphen zu erstellen, werden Temperatur- und Zeitwerte entnommen, die anschließend die Temperatur auf der vertikalen Achse (geordnet) und die Zeit auf der horizontalen Achse (Abscissa) grafisch grafisch grafisch drapieren.
 Abbildung 1. Die Heizkurve einer Substanz wird durch Zugabe von Wärme und Messung der Temperatur in jedem bestimmten Zeitintervall erhalten. Quelle: Pixabay.
Abbildung 1. Die Heizkurve einer Substanz wird durch Zugabe von Wärme und Messung der Temperatur in jedem bestimmten Zeitintervall erhalten. Quelle: Pixabay. Dann wird die am besten geeignete Kurve für diese experimentellen Punkte angepasst und schließlich ein Diagramm der T -Temperatur als Funktion der Zeit t: t (t) erhalten.
[TOC]
Was ist die Heizkurve?
Während es sich wärmt, durchläuft eine Substanz nacheinander unterschiedliche Staaten: Feste solide kann dämpfen, fast immer durch den flüssigen Zustand durchläuft. Diese Prozesse werden als Zustandsänderungen bezeichnet, bei denen die Probe ihre innere Energie bei der Zugabe von Wärme erhöht, wie durch die molekulare kinetische Theorie angezeigt.
Durch Hinzufügen von Wärme zu einer Probe gibt es zwei Möglichkeiten:
- Die Substanz erhöht ihre Temperatur angesichts der Tatsache, dass ihre Partikel mit größerer Intensität gerührt werden.
- Das Material durchläuft eine Phasenänderung, bei der die Temperatur konstant bleibt. Hinzufügen von Wärme hat den Effekt, dass die Kräfte, die Partikel kohäsiv halten.
Abbildung 2 zeigt die vier Materiezustände: Feststoff, Flüssigkeit, Gas und Plasma sowie die Namen der Prozesse, die den Übergang zwischeneinander ermöglichen. Die Pfeile geben die Bedeutung des Prozesses an.
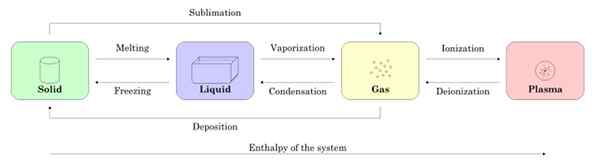 Figur 2. Die Zustände des Subjekts und der Prozesse, die erforderlich sind, um zwischen dem und dem anderen zu bestehen. Quelle: Wikimedia Commons.
Figur 2. Die Zustände des Subjekts und der Prozesse, die erforderlich sind, um zwischen dem und dem anderen zu bestehen. Quelle: Wikimedia Commons. -Zustandsänderungen in einer Substanz
Beginnend mit einer Probe im festen Zustand, wenn das Schmelzen in den flüssigen Zustand übergeht, wird es zu Gas und durch Ionisation wird es Plasma.
Es kann Ihnen dienen: Magnetische Eigenschaften von MaterialienDer Feststoff kann direkt durch den bekannten Prozess als Gas werden Sublimation. Es gibt Substanzen, die bei Raumtemperatur leicht zu untergraben. Das Beste ist co2 oder Trockeneis sowie Naphthalin und Jod.
Während die Probe eine Zustandsänderung überschreitet, bleibt die Temperatur konstant, bis sie den neuen Zustand erreicht. Dies bedeutet, dass beispielsweise ein Teil flüssiger Wasser vorhanden ist, der seinen Siedepunkt erreicht hat, seine Temperatur bleibt konstant, bis das gesamte Wasser Dampf geworden ist.
Aus diesem Grund wird erwartet. Abbildung 3 zeigt eine dieser Kurven für eine bestimmte Substanz.
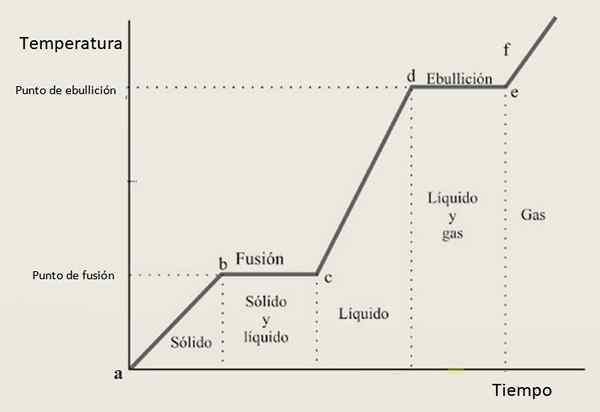 Figur 3. Eine Heizkurve einer bestimmten Substanz mit der typischen Konfiguration basierend auf Schritten und Steigungen.
Figur 3. Eine Heizkurve einer bestimmten Substanz mit der typischen Konfiguration basierend auf Schritten und Steigungen. Interpretation der Heizkurve
In Wachstumsintervallen Ab, CD Und EF Die Substanz wird als fest, Flüssigkeit bzw. Gas gefunden. In diesen Regionen nimmt die kinetische Energie zu und damit die Temperatur.
Währenddessen in BC Sein Zustand von Feststoff zu Flüssigkeit ändert sich, daher koexistieren die beiden Phasen zusammen. Dies ist im Abschnitt der Fall von, in dem die Probe von Gasflüssigkeit übergeht. Hier verändert die potentielle Energie und die Temperatur bleibt konstant.
Das umgekehrte Verfahren ist ebenfalls möglich, dh die Probe kann abgekühlt werden, damit sie nacheinander andere Zustände übernommen werden. In diesem Fall wird von der Rede gesprochen Kühlkurve.
Heizkurven haben den gleichen allgemeinen Aspekt für alle Substanzen, obwohl natürlich nicht die gleichen numerischen Werte. Einige Substanzen erfordern mehr Zeit als andere, um den Zustand zu ändern und bei verschiedenen Temperaturen zu schmelzen und verdampft.
Diese Punkte sind jeweils als Schmelzpunkt und Siedepunkt bekannt und sind Eigenschaften jeder Substanz.
Kann Ihnen dienen: Flache Spiegel: Gleichung, Verhalten, GrafikDeshalb sind die Heizkurven sehr nützlich, da sie den numerischen Wert dieser Temperaturen für Millionen von Substanzen angeben.
Wie wird eine Heizkurve gemacht??
Im Prinzip ist es sehr einfach: Es reicht aus, eine Substanzprobe in einen Behälter zu legen.
Gleichzeitig wird zu Beginn des Verfahrens eine Stoppuhr aktiviert und die entsprechenden Temperaturzeitpaare sind festgestellt.
Die Wärmequelle kann ein Gasleichter sein, mit einer guten Heizgeschwindigkeit oder einem elektrischen Widerstand, der bei Wärme Wärme abgibt, die an eine variable Quelle angeschlossen werden kann, um unterschiedliche Potenzwerte zu erhalten.
Für mehr Präzision gibt es im Chemie -Labor zwei Techniken, die weit verbreitet sind:
- Differentielle thermische Analyse.
- Differentielle kalorimetrische Kalorimetrie.
Sie vergleichen den Temperaturunterschied zwischen der untersuchten Probe und einer anderen Referenzprobe mit hoher Schmelztemperatur, fast immer ein Aluminiumoxid. Diese Methoden versuchen leicht Fusion- und Siedepunkte zu finden.
Beispiele (Wasser, Eisen ...)
Betrachten Sie die in der Figur gezeigten Heizkurven für Wasser und Eisen. Die Zeitskala wird nicht angezeigt, sie ist jedoch sofort.
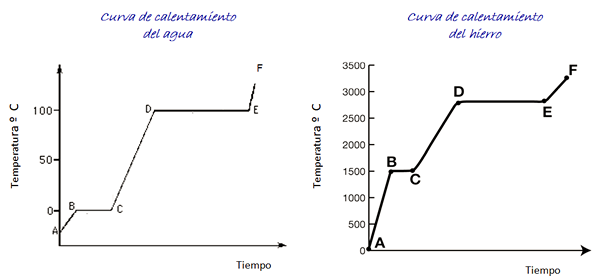 Figur 4. Wasser- und Eisenheizkurven.
Figur 4. Wasser- und Eisenheizkurven. Wasser ist eine universelle Substanz und der Temperaturbereich, der erforderlich ist, um seine Zustandsänderungen zu erkennen, ist im Labor leicht zu erreichen. Für Eisen sind viel höhere Temperaturen erforderlich, aber wie oben angegeben, ändert sich die Form des Diagramms nicht wesentlich.
Kann Ihnen dienen: Steiner Theorem: Erklärung, Anwendungen, ÜbungenSchmelzendes Eis
Beim Erhitzen der Eisprobe sind wir je nach Grafik bei Punkt A bei einer Temperatur unter 0 ° C befinden. Es wird beobachtet, dass die Temperatur mit konstanter Geschwindigkeit ansteigt, bis sie 0 ° C erreicht.
Wassermoleküle im Eis vibrieren mehr Breite. Sobald die Schmelztemperatur (Punkt B) erreicht ist, können sich die Moleküle bereits vor einem anderen bewegen.
Die Energie, die ankommt, wird in die Reduzierung der Anziehungskraft zwischen den Molekülen investiert, so.
Wasser in Dampf verwandeln
Sobald das Wasser vollständig in einem flüssigen Zustand ist. Zwischen D und E bleibt die Temperatur in diesem Wert, während die Energie, die ankommt.
Wenn der gesamte Wasserdampf in einem Behälter enthalten ist, kann es von Punkt E bis Punkt F fortgesetzt werden, dessen Grenze in der Grafik nicht angezeigt wird.
Eine Eisenprobe kann dieselben Veränderungen überqueren. Angesichts der Art des Materials sind die Temperaturbereiche jedoch sehr unterschiedlich.
Verweise
- Atkins, p. Prinzipien der Chemie: Die Wege der Entdeckung. Pan -American Medical Editorial. 219-221.
- Chung, p. Heizkurven. Erholt von: Chem.Librettexts.Org.
- Heizkurven. Wärme der Fusion und Verdampfung. Geborgen von: wikipremed.com.
- Hewitt, Paul. 2012. Konzeptionelle Physik. 5. Ed. Pearson. 174-180.
- Universität Valladolid. Abschluss in Chemie, wiedererlangt von: Unterkunft.Traube.Ist.
- « Carnot -Zyklusstadien, Anwendungen, Beispiele, Übungen
- Bromocresol -grüne Eigenschaften, Vorbereitung, verwendet »

