Zinkfinger, Struktur, Klassifizierung, Funktion
- 4792
- 625
- Rieke Scheer
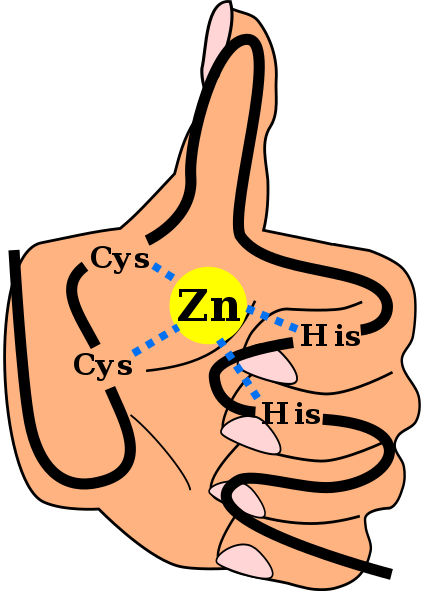
 Primärstruktur einer Zinkfingerdomäne C2H2, einschließlich der Links, die das Zinkionen koordinieren, und mit einem Hintergrund von "Hand und Finger". Angel Herraez, Wikimedia Commons
Primärstruktur einer Zinkfingerdomäne C2H2, einschließlich der Links, die das Zinkionen koordinieren, und mit einem Hintergrund von "Hand und Finger". Angel Herraez, Wikimedia Commons Der Zinkfinger (ZF) sind Strukturmotive, die in einer großen Anzahl von Eukaryoten vorhanden sind. Sie gehören zur Metalloproteingruppe, da sie das Zinkmetallion vereinen können, das sie für seinen Betrieb benötigen. Es wird vorausgesagt, dass in rund 1000 verschiedenen Proteinen beim Menschen mehr als 1500 ZF -Domänen existieren.
Der Begriff Zinkfinger oder „Zinkfinger“ wurde erstmals 1985 von Miller, McLachlan und Klug geprägt, während sie die kleinen Domänen der DNA der DNA des Transkriptionsfaktors tfiiia von detailliert untersuchten Xenopus laevis, beschrieben von anderen Autoren einige Jahre zuvor.
Proteine mit ZF -Motiven sind im Genom eukaryotischer Organismen am häufigsten und beteiligen Andere.
Struktur
Die Struktur von ZF -Motiven ist extrem erhalten. Normalerweise haben diese wiederholten Regionen 30 bis 60 Aminosäuren, deren Sekundärstruktur wie zwei Beta -Antiparallelblätter ist, die eine Gabel bilden, und einen Alpha -Proxy, der als ββα bezeichnet wird.
Diese sekundäre Struktur wird durch hydrophobe Wechselwirkungen und durch die Koordination eines Zinkatoms stabilisiert2Sein2). Es gibt jedoch ZF, die mehr als ein Zinkatom und andere koordinieren können.
Kann Ihnen dienen: Palmitholeinsäure: Struktur, Funktionen, wo ist esZFs können in Stapel wiederholt werden, linear im selben Protein konfiguriert. Alle haben ähnliche Strukturen, aber sie können sich chemisch durch Variationen von wichtigen Aminosäureabfällen zur Erfüllung ihrer Funktionen unterscheiden.
Ein gemeinsames Merkmal zwischen ZF ist seine Fähigkeit, DNA- oder RNA.
Im Allgemeinen beträgt die Erkennung 3PB -Regionen in der DNA und wird erreicht, wenn das Protein mit ZF -Domäne den Alpha -Propeller zur Hauptnut des DNA -Moleküls darstellt.
Einstufung
Es gibt unterschiedliche ZF. Eine der Klassifizierungen ist wie folgt:
C2H2
Dies ist ein Grund, der häufig im ZF zu finden ist. Die meisten Gründe c2H2 Sie sind spezifisch für die Wechselwirkung mit DNA und RNA. Sie wurden jedoch beobachtet, die an Protein-Protein-Wechselwirkungen beteiligt sind. Sie haben zwischen 25 und 30 Aminosäureabfällen und befinden sich in der größten Familie von regulatorischen Proteinen bei Säugetierern.
C2H
Interagieren Sie mit RNA und einigen anderen Proteinen. Sie werden hauptsächlich als Teil einiger Proteine des Retrovirus -Capsids beobachtet, die kurz nach der Replikation bei der Verpackung der viralen RNA zusammenarbeiten.
C4 (Schleife oder Klebeband)
Proteine mit diesem Motiv sind Enzyme, die für die Replikation und Transkription von DNA verantwortlich sind. Ein gutes Beispiel dafür kann die rohen Enzyme der Phagen T4 und T7 sein.
C4 (Familie Gata)
Diese ZF -Familie umfasst Transkriptionsfaktoren, die die Expression wichtiger Gene in zahlreichen Geweben während der Zellentwicklung regulieren. Zum Beispiel sind GATA-2 und 3 Faktoren an der Hämatopoese beteiligt.
Es kann Ihnen dienen: ATP (Adenosine Triffosphat)C6
Diese Domänen sind typisch für Hefe, insbesondere für das Gal4 -Protein, das die Transkription von Genen aktiviert, die an der Verwendung von Galactose und Melibious beteiligt sind.
Zinkfinger (c3HC4-C3H2C3)
Diese besonderen Strukturen haben 2 ZF -Domänen -Subtypen (C3HC4 und C3H2C3) und sind in zahlreichen tierischen und pflanzlichen Proteinen vorhanden.
Sie kommen in Proteinen wie Rad5 vor, die an der DNA -Reparatur in eukaryotischen Organismen beteiligt sind. Sie sind auch in RAG1 gefunden, die für die Neukonfiguration von Immunglobulinen unverzichtbar sind.
H2C2
Diese ZF -Domäne ist in Retrovirus- und Retrotransposon -Integralen stark erhalten. Beim Schließen des weißen Protein.
Funktionen
ZF -Domänen -Proteine dienen verschiedenen Zwecken: Sie können in ribosomalen Proteinen oder Transkriptivadaptern gefunden werden. Sie wurden auch als integraler Bestandteil der Struktur der RNA -Polymerase II von Hefe nachgewiesen.
Sie scheinen an der intrazellulären Zinkhomöostase und an der Regulierung der Apoptose oder des programmierten Zelltods beteiligt zu sein. Darüber hinaus gibt es einige ZF -Proteine, die als Chaperone zum Falten oder Transport anderer Proteine fungieren.
Lipidvereinigung und eine grundlegende Rolle bei Protein-Protein-Wechselwirkungen sind auch herausragende Funktionen von ZF-Domänen in einigen Proteinen.
Biotechnologische Bedeutung
Im Laufe der Jahre hat das strukturelle und funktionelle Verständnis der ZF -Domänen große wissenschaftliche Fortschritte ermöglicht, die die Verwendung ihrer Merkmale für biotechnologische Zwecke implizieren.
Da einige ZF -Proteine aufgrund bestimmter DNA -Domänen eine große Spezifität haben, wird derzeit viel Aufwand in das spezifische ZF -Design investiert, was wertvolle Fortschritte bei der Gentherapie beim Menschen bieten kann.
Es kann Ihnen dienen: Chinas Flora und Fauna: Repräsentative ArtenInteressante biotechnologische Anwendungen ergeben sich auch aus dem Proteindesign mit ZF, das durch Gentechnik modifiziert wurde. Je nach gewünscht.
Die genomische Ausgabe mit modifiziertem Nukleas ist heute eine der vielversprechendsten Anwendungen. Diese Art von Ausgabe bietet die Möglichkeit, Studien zur genetischen Funktion direkt im interessierenden System durchzuführen.
Gentechnik unter Verwendung modifizierter ZF -Nukleasas hat die Aufmerksamkeit von Wissenschaftlern auf dem Gebiet der genetischen Verbesserung von Sorten von agronomischen Bedeutung auf sich gezogen. Diese Nukleas wurden verwendet, um ein endogenes Gen zu korrigieren, das herbizidresistente Formen in Tabakpflanzen erzeugt.
Nukleas mit ZF wurden auch zur Zugabe von Genen in Säugetierzellen verwendet. Die fraglichen Proteine wurden verwendet, um eine Reihe von isogenen Mauszellen mit einer Reihe von Allelen zu erzeugen, die für ein endogenes Gen definiert sind.
Ein solcher Prozess hat eine direkte Anwendung bei der Markierung und die Erstellung neuer allelischer Formen, um Struktur- und Funktionsbeziehungen unter nativen Expressionsbedingungen und in isogenen Umgebungen zu untersuchen.
Verweise
- Berg, j. M. (1990). Zinkfingerdomänen: Hypothesen und aktuelles Wissen. Jährliche Überprüfung der Biophysik und biophysikalische Chemie, 19(39), 405-421.
- Kluska, k., Adamczyk, j., & Krȩzel, a. (2017). Metallbindungseigenschaften von Zinkfingern mit einer natürlich alten Metallbindungsstelle. Metallomik, 10(2), 248-263.

