Halogenierte Derivate

- 3861
- 1072
- Joy Hort
Wir erklären, was die halogenierten Derivate, ihre Eigenschaften, Verwendungen/Anwendungen sind, und wir geben mehrere Beispiele an
Was sind halogenierte Derivate?
Der halogenierte Derivate Sie sind alle Verbindungen mit einem Halogenatom; Das heißt, eines der Elemente der Gruppe 17 (F, Cl, Br, I). Diese Elemente unterscheiden.
Das untere Bild von Halogenen ist im unteren Bild gezeigt. Von oben nach unten: Fluorid (F. F2), Chlor (Cl2), Bromo (Br2) und Jod (ich2). Jede von diesen hat die Fähigkeit, mit der überwiegenden Mehrheit der Elemente zu reagieren, einschließlich zwischen Kongeneren derselben Gruppe (Interhalogene).

So haben halogenierte Derivate eine MX -Formel. Die letzten beiden befinden sich in der Kategorie Bio -Haluros. Die Stabilität dieser Verbindungen erfordert einen Energie -Nutzen vor dem ursprünglichen Soda -Molekül.
In der Regel bildet das Fluorid halogener stabiler als Jod. Der Grund ist die Unterschiede zwischen ihren Atomradios (die lila Kugeln sind sperriger als die gelben).
Durch Erhöhen des Atomradius ist die Überlappung der Orbitale zwischen Halogen und dem anderen Atom ärmer, und daher ist die Verbindung schwächer.
Nomenklatur
Der Weg, diese Verbindungen korrekt zu benennen, hängt davon ab, ob sie anorganisch oder organisch sind.
Anorganisch
Metallische Halogenide bestehen aus einer Ionen oder kovalenten Bindung zwischen einem Halogen X und einem M -Metall (der Gruppen 1 und 2, Übergangsmetalle, Schwermetallen usw.).
In diesen Verbindungen haben alle Halogene einen Oxidationszustand von -1. Weil? Weil seine Valencia -Konfigurationen NS sind2Np5.
Daher müssen sie nur ein Elektron gewinnen, um das Oktett von Valencia zu vervollständigen, während die Metalle oxidieren und ihnen die Elektronen geben, die sie haben.
Kann Ihnen dienen: Präzisionsausgleich: Merkmale, Funktionen, Teile, verwendetSo bleibt Fluorid als f-, Fluorid; Das Cl-, Chlorid; die Br-, Bromid; und das i-, Ich zuletzt. MF würde benannt: Fluorid von (Metallname) (n), das N -Metall Valencia del nur dann ist, wenn es mehr als eins hat. Bei Gruppen der Gruppen 1 und 2 ist es nicht erforderlich, Valencia zu benennen.
Beispiele
- NAF: Natriumfluorid.
- CaCl2: Calciumchlorid.
- AGBR: Silberbromid.
- Zni2: Zink Yoduro.
- CUCL: Kupferchlorid (i).
- Cucl2: Kupferchlorid (ii).
- Ticl4: Titanchlorid (IV) oder Titano Tetrachlorid.
Wasserstoff und nicht -metalische Elemente - sogar dieselben Halogene - können jedoch auch Haluros bilden. In diesen Fällen wird das Valencia of the No Metall am Ende nicht ernannt:
- PCL5: Phosphor Pentachlorid.
- Bf3: Boro Trifluoruro.
- Ali3: Aluminium Triyoduro.
- HBR: Wasserstoffbromid.
- Wenn7: Jod Heptofluorid.
Organisch
Unabhängig davon, ob RX oder ARX, ist der Halogen kovalent mit einem Kohlenstoffatom verbunden. In diesen Fällen werden Halogene unter ihren Namen erwähnt, und der Rest der Nomenklatur hängt von der molekularen Struktur von R oder AR ab.
Für das einfachste organische Molekül Methan (Cho4) Die folgenden Derivate werden erhalten, indem das H durch CL ersetzt wird:
- CH3CL: Chlormethan.
- CH2Cl2: Dichlormethan.
- CHCL3: Tricylormethan (Chloroform).
- CCL4: Tetrachlormethan (Kohlenstoffchlorid (IV) oder Kohlenstoff Tetrachlorid).
Hier besteht R aus einem einzigen Kohlenstoffatom. Dann wird für andere aliphatische Ketten (lineare oder Zweige) die Anzahl der Kohlenstoffe gezählt, von denen sie mit dem Halogen verbunden sind:
CH3CH2CH2F: 1-Fluorpropano.
Das vorherige Beispiel war das eines primären alquilischen Halogenids. Für den Fall, dass die Kette verzweigt ist, wird das längste, der den Halogen enthält, ausgewählt und beginnt zu zählen, sodass dies als mögliche Zahl bleibt:
Kann Ihnen dienen: Was sind die physikalischen Eigenschaften der Materie??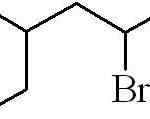
3-Methyl-5-Bromhexan
Genauso wie es für andere Substituenten auftritt. Auch für die aromatischen Halogenide wird der Halogen ernannt und dann der Rest der Struktur:

Das überlegene Bild zeigt die Verbindung namens Bromobenzol und hebt das Bromatom in Braun hervor.
Eigenschaften von halogenierten Derivaten
Anorganische Halogenide
Anorganische Halogenide sind ionische oder molekulare Feststoffe, obwohl erstere häufiger vorkommen. Abhängig von den Wechselwirkungen und ionischen Funkgeräten von MX ist dies in Wasser oder anderen weniger polaren Lösungsmitteln löslich.
Nicht -metallische Halogenide (wie Boro) sind normalerweise Lewis -Säuren, was bedeutet, dass sie Elektronen zur Bildung von Komplexen akzeptieren. Andererseits produzieren Halogenide (oder Halogenuros) aus Wasserstoff, die in Wasser gelöst sind.
Seine Schmelzpunkte, Kochen oder Sublimation fallen auf elektrostatische oder kovalente Wechselwirkungen zwischen Metall oder Nicht -Metall mit Halogen.
Ebenso spielen ionische Radios eine wichtige Rolle in diesen Eigenschaften. Zum Beispiel wenn m+ und x- Sie haben ähnliche Größen, ihre Kristalle werden stabiler sein.
Bio -Halogenide
Sie sind polar. Weil? Weil der Unterschied in der Elektronegativitäten zwischen C und Halogen ein dauerhaftes polares Moment im Molekül erzeugt. Dies nimmt auch ab, wenn die Gruppe 17 abfällt, von der C-F-Verbindung zu C-I.
Ohne die molekulare Struktur von R oder AR zu berücksichtigen, beeinflussen die wachsenden Halogenzahlen direkt die Siedepunkte, da sie die Molmasse und die intermolekulare Wechselwirkungen erhöhen (RC-X-X-CR). Die meisten sind mit Wasser nicht mischbar, können sich aber in organischen Lösungsmitteln auflösen.
Verwendung von halogenierten Derivaten
Die Verwendung von halogenierten Derivaten könnte ihren eigenen Text reservieren. Die molekularen "Gefährten" von Halogenen sind ein Schlüsselfaktor, da ihre Eigenschaften und Reaktivitäten die Verwendung des Derivats definieren.
Kann Ihnen dienen: Kaliumsulfat (K2SO4): Struktur, Eigenschaften, Verwendungszwecke, SyntheseDaher hebt sich die große Vielfalt möglicher Verwendungen aus:
- Molekulare Halogene werden verwendet, um Halogenlampen zu erzeugen, bei denen Sie sich mit dem Glühlampe -Wolfram -Filament in Verbindung setzen. Der Zweck dieser Mischung besteht darin, das Halogen X mit dem verdampften Wolfram zu reagieren. Auf diese Weise wird seine Ablagerung auf der Oberfläche der Glühbirne vermieden und garantiert mehr Lebenszeit.
- Fluorsalze werden zur Fluorisierung von Zahngewässern und Pasten verwendet.
- Natrium- und Calciumhypochlorite sind zwei aktive Wirkstoffe in kommerziellen Bleichlösungen (Chlor).
- Obwohl sie die Ozonschicht verschlechtern, werden Chlorfluorkohlenwasserstoffe (CFCs) in Aerosolen und Kühlsystemen verwendet.
- Vinylchlorid (Cho2= CHCL) ist das Monomer des Polyvinylpolymerchlorids (PVC). Andererseits besteht das als nicht sticke Material verwendete Teflon aus polymeren Ketten von Tetrafluorethylen (F. F. F2C = vgl2).
- Sie werden in analytischer Chemie und organischer Synthese für verschiedene Zwecke verwendet. Unter diesen Arzneimittelsynthese.
Zusätzliche Beispiele

Das überlegene Bild zeigt das Schilddrüsenhormon, das für die Wärmeerzeugung sowie die Zunahme des allgemeinen Stoffwechsels im Körper verantwortlich ist. Diese Verbindung ist ein Beispiel für ein halogeniertes Derivat, das im menschlichen Körper vorhanden ist.
Unter anderen halogenierten Verbindungen werden Folgendes erwähnt:
- Diclorodifenilriclorootan (DDT), effizientes Insektizid, jedoch mit schwerwiegenden Umweltauswirkungen.
- Zinnchlorid (SNNCL2), verwendet als Reduktionsmittel.
- Chlorethan oder 1-Chlorethan (CH3CH2CL), topische Anästhetikum, die schnell die Haut abkühlt.
- Dichlorethylen (clch = cclh) und Tetrachlorethylen (CL)2C = CCL2), verwendet als Lösungsmittel in der chemischen Reinigungsindustrie.
- « Chemische Struktur, Eigenschaften und Verwendung von Siliziumkarbid -Carbid
- 80 Phrasen für die erste Liebe, die nie vergisst »

