Protein -Denaturierung Was ist, Faktoren, Konsequenzen
- 3184
- 60
- Nick Laurén
Was ist die Denaturierung von Proteinen?
Der Protein -Denaturierung Es besteht aus dem Verlust einer dreidimensionalen Struktur aufgrund unterschiedlicher Umgebungsfaktoren wie Temperatur, pH -Wert oder bestimmten chemischen Wirkstoffen. Der Verlust der Struktur führt zum Verlust der biologischen Funktion, die mit diesem Protein verbunden ist, ob enzymatisch, strukturell, Transporter, unter anderem.
Die Struktur des Proteins ist sehr empfindlich gegenüber Veränderungen. Die Destabilisierung einer einzelnen essentiellen Wasserstoffbrücke kann das Protein denaturalisieren. Auf die gleiche Weise gibt es Wechselwirkungen, die nicht ausschließlich wichtig sind, um die Proteinfunktion zu erfüllen, und im Falle einer Destabilisierung hat es keinen Einfluss auf den Betrieb.
Proteinstruktur
Um die Protein -Denaturierungsprozesse zu verstehen, müssen wir wissen, wie Proteine organisiert sind. Diese haben eine primäre, sekundäre, tertiäre und quaternäre Struktur.
Primärstruktur
Es ist die Aminosäuresequenz, die dieses Protein ausmacht. Aminosäuren sind die grundlegenden Blöcke, die diese Biomoleküle bilden, und es gibt 20 verschiedene Typen mit bestimmten physikalischen und chemischen Eigenschaften. Sie verbinden sich mit einem Peptidverbindung zusammen.
Sekundärstruktur
In dieser Struktur beginnt diese lineare Kette von Aminosäuren durch Wasserstoffbrücken gefaltet zu werden. Es gibt zwei grundlegende sekundäre Strukturen: den α -Propeller, spiralförmig; und das Faltblatt -β, wenn zwei lineare Ketten parallel ausgerichtet sind.
Tertiärstruktur
Es beinhaltet andere Arten von Kräften, die zu einer spezifischen Faltung der dreidimensionalen Form führen.
Die R -Ketten von Aminosäureresten, aus denen die Struktur des Proteins besteht. Die Kräfte von Van der Waals fungieren als Stabilisator der beschriebenen Wechselwirkungen.
Kann Ihnen dienen: Isoleucin: Eigenschaften, Funktionen, Biosynthese, LebensmittelQuartärstruktur
Es besteht aus Aggregaten von Proteineinheiten.
Wenn ein Protein denaturiert ist, verliert es die quartäre, tertiäre und sekundäre Struktur, während der primäre intakt bleibt. Proteine, die reich an Disulfidverbindungen sind (Tertiärstruktur).
Faktoren, die Denaturierung verursachen
Jeder Faktor, der nicht kalvalente Bindungen destabilisiert, die für die Aufrechterhaltung der nativen Struktur des Proteins verantwortlich sind. Zu den wichtigsten können wir erwähnen:
pH
Bei sehr extremen pH -Werten, ob saure oder grundlegende Mittel, kann Protein seine dreidimensionale Konfiguration verlieren. Der überschüssige Ehrungen h h+ und oh- im Mittelpunkt destabilisiert Proteinwechselwirkungen.
Diese Änderung des Ionenmusters erzeugt Denaturierung. Die PH -Denaturierung kann in einigen Fällen und in anderen Irreversiblen reversibel sein.
Temperatur
Die thermische Denaturierung erfolgt durch Erhöhung der Temperatur. In Organismen, die unter durchschnittlichen Umweltbedingungen leben, beginnen Proteine bei Temperaturen von mehr als 40 ° C zu destabilisieren. Offensichtlich können thermophile Organismus -Proteine diese Temperaturbereiche unterstützen.
Temperaturerhöhungen werden zu Erhöhungen der molekularen Bewegungen, die Wasserstoffbrücken und andere nichtkovalente Bindungen beeinflussen, übersetzt.
Diese Temperaturerhöhungen führen zu Reaktionsgeschwindigkeit, wenn wir über Enzyme sprechen.
Chemikalien
Polare Substanzen wie Harnstoff in hohen Konzentrationen beeinflussen Wasserstoffbrücken. Ebenso können nicht -polare Substanzen ähnliche Folgen haben.
Reinigungsmittel können auch die Proteinstruktur destabilisieren; Es ist jedoch kein aggressiver Prozess und sie sind größtenteils reversibel.
Kann Sie dienen: Deutsche Kakerlake: Eigenschaften, Reproduktion, LebensmittelReduzierende Agenten
Β-Mercaptoetanol (Hoch2ch2sh) ist ein häufiges Chemiemittel im Labor, um Proteine zu denaturalisieren. Es ist verantwortlich für die Reduzierung von Disulfidbrücken zwischen Aminosäureabfällen. Kann die tertiäre oder quaternäre Struktur des Proteins destabilisieren.
Ein weiterer Reduktionsmittel mit ähnlichen Funktionen ist Ditiotreitol (DTT). Darüber hinaus sind andere Faktoren, die zum Verlust der nativen Struktur in Proteinen beitragen.
Folgen der Protein -Denaturierung
Wenn die Denaturalisierung auftritt, verliert das Protein seine Funktion. Proteine arbeiten optimal, wenn sie in ihrem Heimatstaat sind.
Der Verlust der Funktion ist nicht immer mit einem Denaturierungsprozess verbunden. Eine kleine Änderung der Proteinstruktur kann zum Funktionsverlust führen, ohne die gesamte dreidimensionale Struktur zu destabilisieren.
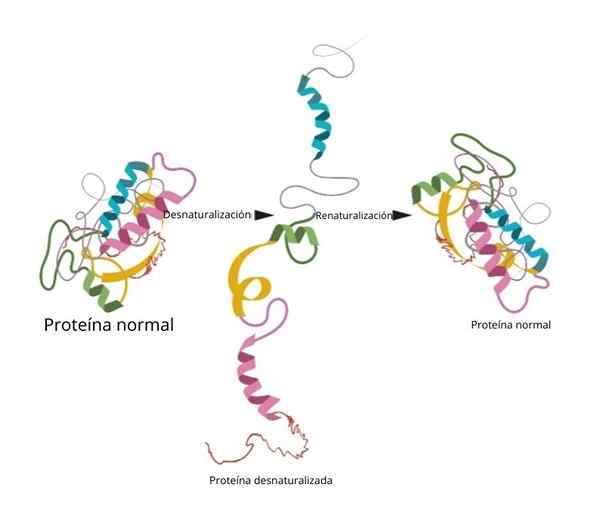
Der Prozess kann irreversibel sein oder auch nicht. Wenn die Bedingungen im Labor umgekehrt sind, dass das Protein zu seiner anfänglichen Konfiguration zurückkehrt.
Renaturalisierung
Eines der berühmtesten und abschließendsten Experimente zur Renaturalisierung wurde in der Ribonuklease nachgewiesen.
Wenn die Forscher Denaturierungsmittel wie Harnstoff oder β-Mercaptanol hinzufügten, wurde das Protein denaturiert. Wenn diese Mittel entfernt wurden, kehrte das Protein zu ihrer nativen Konformation zurück und konnte ihre Funktion mit einer Effizienz von 100 % ausführen.
Eine der wichtigsten Schlussfolgerungen dieser Forschung war es, experimentell zu zeigen, dass die dreidimensionale Konformation des Proteins durch seine Primärstruktur gegeben wird.
In einigen Fällen ist der Denaturalisierungsprozess völlig irreversibel. Wenn wir beispielsweise ein Ei kochen, wenden wir Wärme in Proteinen (das Haupt Albumin), das es ausmacht, das Klar ist ein festes und weißliches Aussehen. Intuitiv kann zu dem Schluss kommen, dass es, obwohl wir es abkühlen.
Kann Ihnen dienen: Ovogenese: Phasen, Eigenschaften bei Tieren und PflanzenIn den meisten Fällen geht der Denaturalisierungsprozess mit dem Verlust der Löslichkeit einher. Viskosität, Diffusionsgeschwindigkeit wird ebenfalls reduziert und kristallisiert leichter.
Chaperonas -Proteine
Chaperonas oder Chaperoninproteine sind für die Verhinderung der Denaturierung anderer Proteine verantwortlich. Sie unterdrücken auch bestimmte Wechselwirkungen, die unter Proteinen nicht ausreichend sind, um eine korrekte Faltung von ihnen zu gewährleisten.
Wenn die mittlere Temperatur zunimmt, erhöhen diese Proteine ihre Konzentration und wirken, indem die Denaturierung anderer Proteine verhindert wird. Deshalb werden sie auch als "thermische Schockproteine" oder HSP als Akronym in Englisch bezeichnet (Hitzeschockproteine).
Chaperonine sind analog zu einem Käfig oder Fass, das das interessierende Protein im Inneren schützt.
Diese Proteine, die auf zelluläre Stresssituationen reagieren. Es gibt verschiedene Arten von Chaperoninen und werden nach ihrem Molekulargewicht klassifiziert.

