Dibenzalacetona -Eigenschaften, Reaktionsmechanismus, Anwendungen, Risiken

- 642
- 96
- Lewis Holzner
Der Dibenzalacetona (DBA) ist eine organische Verbindung, deren molekulare Formel C ist17H14ENTWEDER. Es ist ein gelblicher Feststoff, der je nach Reinheit als Kristalle dargestellt werden kann. Es wird in Sonnenschutzmitteln und der organethalischen Synthese verwendet, in der das Paladium als Katalysator verwendet wird.
Während seine Synthese ein relativ einfacher, ziemlich wiederkehrender Prozess in Lehren von Labors zur Erklärung der aldolischen Kondensation ist, ist der Mechanismus etwas umfangreich. Es sollten mehrere Faktoren berücksichtigt werden. Das verwendete Benzaldehyd, das mit Aceton kondensiert, muss neu destilliert werden, um seine niedrige Oxidation in Kontakt mit der Luft zu garantieren.
 Dibenzalacetona -Probe im Glasbehälter. Quelle: Stephanb [CC BY-SA (http: // CreateRecommons.Org/lizenzen/by-sa/3.0/]]
Dibenzalacetona -Probe im Glasbehälter. Quelle: Stephanb [CC BY-SA (http: // CreateRecommons.Org/lizenzen/by-sa/3.0/]] Ebenso wird ein Ethanol-Wasser-Medium verwendet. Bisher ist nicht bekannt, welche negativen Auswirkungen Dibenzalaceton auf den Organismus oder die Umwelt ausüben können, anstatt eine irritierende Substanz zu sein.
[TOC]
Eigenschaften
Aussehen
Massives gelbliches staubiges oder kristallines Aussehen.
Molmasse
234.29 g/mol
Isomere
Dibenzalaceton wird als drei geometrische Isomere dargestellt: Trans-trans-trans-cis und cis-cis. Das Trans-Trans-Isomer ist das stabilste und daher derjenige, der während der Synthese am meisten auftritt.
Schmelzpunkt
110-111 ºC. Dieser Bereich variiert je nach Reinheitsgrad des synthetisierten Feststoffs.
Wasserlöslichkeit
Unlöslich.
Struktur
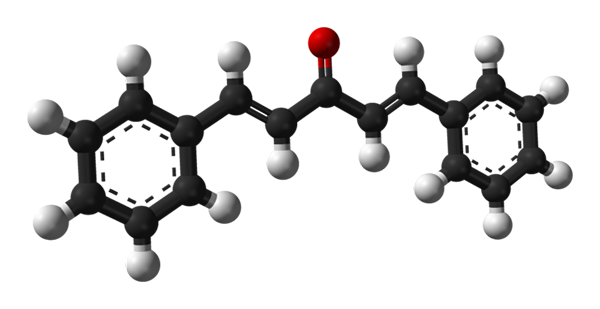 Molekülstruktur von Dibenzalaceton. Quelle: Benjah-BMM27 [Public Domain]
Molekülstruktur von Dibenzalaceton. Quelle: Benjah-BMM27 [Public Domain] Im oberen Bild wird das Molekül des Trans-Trans-Trans-Isomers gezeigt. Im Zentrum haben wir die Carbonylgruppe und an ihren Seiten, Doppelbindungen und zwei aromatischen Bonenceno -Ringen.
Dibenzalaceton befindet sich in apolarer und hydrophober Essenz. Die Carbonylgruppe gibt ihm nur einen kleinen Dipolmoment.
Kann Ihnen dienen: Aluminiumphosphuro (AIP): Struktur, Eigenschaften, Verwendungen, RisikenDie Struktur kann mit der eines Blechs gleichgesetzt werden, da alle ihre Kohlenstoffatome SP -Hybridisierung aufweisen2; Daher ruhen sie in derselben Ebene.
Lichtphotonen interagieren mit dem konjugierten π -System des Dibenzalacetonas; insbesondere solche von UV -Strahlung, die absorbiert werden, um umgezogene Elektronen zu erregen. Diese Eigenschaft macht Dibenzalacetona zu einem ausgezeichneten Absorption von Ultraviolettlicht.
Dibenzalacetona -Reaktionsmechanismus
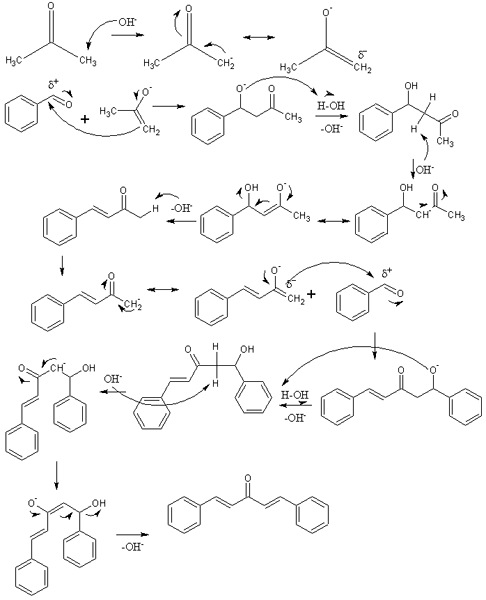 Mechanismus der aldolischen Kondensation bei der Synthese von Dibenzalacetona. Quelle: Izmaelt [CC BY-S (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Mechanismus der aldolischen Kondensation bei der Synthese von Dibenzalacetona. Quelle: Izmaelt [CC BY-S (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] In dem überlegenen Bild haben wir den Mechanismus der aldolischen Kondensation zwischen Benzaldehyd und Aceton dargestellt, um das Dibenzalaceton zu entstehen; Insbesondere sein Trans-Trans-Isomer.
Die Reaktion beginnt mit Aceton in Basismedium. OH- Unweit ein Säureproton einer seiner beiden Methylgruppen -ch3, Auf ein Ungelolerungen führen: Cho3C (o) ch2-, die seine negative Resonanzbelastung verlagert (erste Zeile des Bildes).
Dieses Inol wirkt dann als nukleophiles Mittel: greift die Carbonylgruppe eines Benzaldehydmoleküls an. Sein Einbau in das Benzaldehyd erzeugt ein Alcoxid, das, weil es sehr grundlegend ist, ein Wassermolekül zu verheerenden und zu einem Aldol (zweite Reihe) wird (zweite Reihe). Das Aldol oder β-Hydroxychithon ist durch Gruppen C = O und OH gekennzeichnet.
Das grundlegende Medium dehydriert dieses Aldol und eine Doppelbindung, die in seiner Struktur gebildet wird, was das Benzylideneaceton (dritte Reihe) erzeugt, erzeugt (dritte Reihe). Dann oh- Auch unscharfes eines seiner sauren Hydrogene und wiederholt einen weiteren nucleophilen Angriff auf ein zweites Benzaldehydmolekül. Diesmal findet der Angriff so schnell statt (vierte Reihe).
Das Produkt bildete ungeschützte ein weiteres Wassermolekül und leidet erneut an einer Dehydration, um die OH -Gruppe zu beseitigen und eine zweite Doppelbindung aufzubauen (fünfte und sechste Zeilen). So und schließlich tritt Dibenzalacetona auf.
Kann Ihnen dienen: Boyle LawSynthese
Reagenzien
Die Reagenzien zur Durchführung der Synthese des Dibenzalaceton sind Folgendes:
- 95% Ethanol.
- Neu destilliertes Benzaldehyd von Bittermandelöl.
- Naoh als Grundkatalysator in destilliertem Wasser.
Die zu verwendenden Mengen hängen davon ab, wie viel Dibenzalaceton es synthetisieren soll. Es gibt jedoch einen Überschuss an Benzaldehyd, da ein Teil davon zu Benzosäure oxidiert wird. Es ist auch garantiert, dass die Reaktion weniger Zeit dauert und dass das unerwünschte Benzylidenaceton in geringerem Maße erzeugt wird.
Ethanol wirkt als Lösungsmittel von Benzaldehyd, da es sich sonst nicht in der grundlegenden Umgebung von Naoh auflösen würde.
Verfahren
In einem großen Niederschlag Glas wird Ethanol mit Benzaldehyd gemischt. Dann wird das Grundmedium NaOH während einer konstanten magnetischen Bewegung zugesetzt. In diesem Schritt tritt die Cannizzaro -Reaktion auf; Das heißt.
Schließlich wird Aceton hinzugefügt und eine halbe Stunde wird erwartet, dass die Lösung wolkig und eine gelb-orangefarbene Farbe wird. Dibenzalacetona wird aufgrund von Wasser ausfällt, sodass ein beträchtliches Wasservolumen hinzugefügt wird.
Dibenzalacetona filtert in ein Vakuum und sein gelblicher Feststoff war mehrmals Lava mit destilliertem Wasser.
Rekristallisation
 Eine rekristallisierte Probe von Dibenzalacetona muss einen Glanz tragen, ähnlich der der Kristalle dieses Bildes. Quelle: Smokefoot [CC BY-SA (https: // createRecommons.Org/lizenzen/by-sa/4.0)]]
Eine rekristallisierte Probe von Dibenzalacetona muss einen Glanz tragen, ähnlich der der Kristalle dieses Bildes. Quelle: Smokefoot [CC BY-SA (https: // createRecommons.Org/lizenzen/by-sa/4.0)]] Um Dibenzalaceton, 95% Ethanol oder Heißethylacetat zu reinigen. Somit wird der anfängliche gelbliche Staub in kleine gelbe Kristalle von Dibenzalacetona umgewandelt.
Kann Ihnen dienen: Benzoesäure (C6H5COOH)Anwendungen
Dibenzalacetona ist eine Verbindung, die nicht zu viele Verwendungszwecke hat. Aufgrund seiner Fähigkeit, ultraviolettes Licht aufzunehmen, wird es bei der Formulierung von Sonnenschutzmitteln oder jedem anderen Produkt verwendet, das die Inzidenz von UV -Strahlen entweder Beschichtungen oder Gemälde plagt.
Andererseits wird Dibenzalaceton in der organometallischen Synthese des Paladiums verwendet. Es wirkt als Bindung, die die metallischen Paladiumatome PD koordiniert0, Um den Tris -Komplex (Dibenzenacetona) Dipaladio (0) zu bilden.
Diese organometallische Verbindung liefert PD -Atome0 In verschiedenen organischen Synthese verhält es sich wie ein homogener Katalysator, da es sich in vielen organischen Lösungsmitteln auflöst.
Ebenso ist Dibenzalacetona als Bindemittel leicht durch andere organische Bindemittel ersetzt, wodurch sich die organometallische Synthese des Paladiums entwickelt hat.
Risiken
In Bezug auf die Risiken stehen nicht viele Informationen zur Verfügung, die über die möglichen Auswirkungen auf die Gesundheit oder die Umgebung berichtet, die zu Dibenzalaceton führen können. In seinem reinen Zustand ist es ein irritierendes Feste für die Aufnahme, Atmung oder direkten Kontakt mit den Augen oder Haut.
Es ist jedoch anscheinend nicht genug irritierend, so dass es nicht Teil der Formulierungen von Sonnenschutzmitteln sein kann. Andererseits ist es vernachlässigbar, so unlöslich in Wasser zu sein, und zeigt sich als feste Verunreinigung. In diesem Sinne ist es nicht bekannt, wie schädlich es für Meeresfauna oder Böden die Trübung ist, die verursacht.
Bis das Gegenteil demonstriert ist.
Verweise
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. 5. Ausgabe. Editorial Addison-Wesley Interamerikaner.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10. Ausgabe.). Wiley Plus.
- Wikipedia. (2020). Dibenzylideneaceton. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2020). Dibenzylideneaceton. Pubchem -Datenbank., CID = 640180. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Organische Synthesizer. (2020). Dibenzalaceton. Abgerufen von: orsyn.Org
- Dibenzalaceton durch Aldol -Kondensation. Abgerufen von: Web.Mnstate.Edu
- « Merkmale der Wärmeleistung, Folgen, Beispiele
- Iodometrie -Grundlagen, Reaktionen, allgemeines Verfahren, verwendet »

