Dichlormethanstruktur, Eigenschaften, Verwendungen, Toxizität

- 3401
- 527
- Said Ganzmann
Er Dichlormethan, Auch als Methylenchlorid bekannt, handelt es sich um eine organische Verbindung, deren chemische Formel CH ist2Cl2. Insbesondere handelt es sich um ein Alkylhalogenid, das aus Methangas stammt. Im Gegensatz zu Methan ist diese Verbindung eine farblose und polare Flüssigkeit.
Es wurde ursprünglich 1839 vom französischen Chemiker und Physiker Henri Victor Regnault (1810-1878) synthetisiert, der es schaffte, ihn aus einer Mischung aus Chlor und Chlormethan zu isolieren, die Sonnenlicht ausgesetzt war.
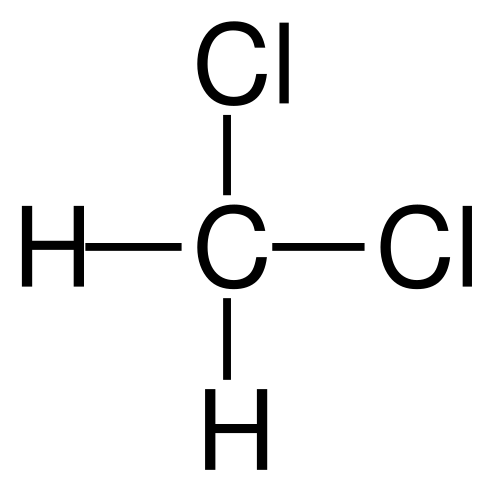 Strukturformel des Dichlormethans. Quelle: Jü [Public Domain]
Strukturformel des Dichlormethans. Quelle: Jü [Public Domain] Das Dichlormethan erfolgt industriell durch die Behandlung von Methan oder Chlormethan mit Chlorgas bei hoher Temperatur (400-500 ° C). Zusammen mit dem Dichlormethan treten sie im Prozess des Chloroform- und Kohlenstoff -Tetrachlorids auf, die durch Destillation getrennt sind.
Das Dichlormethan wird als Lösungsmittel verwendet, das das Schweißen von Kunststoffmaterialien ermöglicht und Metalle entlarven kann. Es wird auch in Kaffee und Tee Dekaffein verwendet.
Das Dichlormethan ist eine toxische Verbindung, die durch Inhalation von Nasenlöchern und Rachen produzieren kann. In exponierten Arbeitnehmern wurde in hohen Konzentrationen des Dichlormethan. Darüber hinaus ist er mutagener Mittel, der vermutet wird, krebserregend zu sein.
[TOC]
Struktur
 Molekülstruktur des Dichlormethans. Quelle: Gabriel Bolívar über Molview.
Molekülstruktur des Dichlormethans. Quelle: Gabriel Bolívar über Molview. Im ersten Bild wurde die strukturelle Formel des CH gezeigt2Cl2, in denen ihre kovalenten Bindungen C-H und C-C-C-C-CL auffallen. Auf und seine Struktur durch ein Modell von Kugeln und Balken dargestellt. Beachten Sie auf den ersten Blick, dass C-H-Bindungen (weiße Kugeln) kurz sind, während C-Cl (Green-Kugeln) Bindungen lang sind.
Cho Geometrie2Cl2 Es ist tetraedrisch; aber wegen der sperrigsten Chloratome verzerrt. Ein Ende des Tetraeders wird durch die beiden Chloratome definiert, elektronegativer als Wasserstoff und Kohlenstoff. Daher im Molekül von CH2Cl2 Ein dauerhaftes Dipolmoment wird festgestellt (1.6d).
Kann Ihnen dienen: NeutralisationsreaktionDadurch können Dichlormethanmoleküle durch Dipol-Dipolo-Kräfte miteinander interagieren. Ebenso sind diese intermolekularen Wechselwirkungen dafür verantwortlich, dass diese Verbindung trotz ihrer niedrigen Molekülmasse als Flüssigkeit existiert. Eine Flüssigkeit, die jedoch ziemlich volatil ist.
Eigenschaften
Aussehen
Farblose Flüssigkeit.
Molmasse
84,93 g/mol.
Geruch
Süß, ähnlich wie Chloroform.
Riechschwelle
205 - 307 ppm.
Dichte
1,3266 g/cm3 (20 ºC).
Schmelzpunkt
- 97,6 ºC.
Siedepunkt
39,6 ºC.
Wasserlöslichkeit
25,6 g/l bei 15 ºC und 5,2 g/l a 60 ºC.
Das Dichlormethan ist kaum löslich im Wasser. Während beide Moleküle, Cho2Cl2 und h2Oder sie sind polar, ihre Wechselwirkungen sind möglicherweise aufgrund der Abstoßung zwischen Chlor- und Sauerstoffatomen ineffizient.
Löslichkeit in anderen Lösungsmitteln
Mischbar mit Ethylacetat, Alkohol, Hexan, Benzol, Kohlenstofftetrachlor, Dietyl -Ether, Chloroform und Dimethylformamid.
Oktanol/Wasserpartitionskoeffizient
Log p = 1,19.
Dampfdruck
57,3 kPa (25 ºC). Dieser Druck entspricht ungefähr 5,66 atm, was einen hohen Dampfdruck widerspiegelt.
Dampfdichte
2,93 in der Luftbeziehung als 1 genommen.
Brechungsindex (πd)
1.4244 (20 ºC).
Schmiere
0,413 CP (25 ºC).
Zündungspunkt
Das Dichlormethan ist nicht brennbar, aber wenn es mit der Luft gemischt ist, bildet es brennbare Dämpfe über 100 ° C.
Selbstdirektionstemperatur
556 ºC.
Stabilität
Es ist bei der Umgebungstemperatur in Abwesenheit von Feuchtigkeit stabil und hat eine relative Stabilität im Vergleich zu seinen Kongeneren: Carbon -Tetrachlorid -Chloroform und Tetrachlorid.
Es neigt dazu, bei hohen Temperaturen (300-450 ° C) zu carbonisieren, wenn ihre Dämpfe mit Stahl- und Metallchloriden in Kontakt kommen.
Zersetzung
Es kann in Kontakt mit heißen Oberflächen oder einer Flamme unterteilt werden, wodurch giftige und irritierende Dämpfe von Phosgen und Wasserstoffchlorid abgebildet werden.
Kann Ihnen dienen: DifferentialelektronKorrosion
Das Dichlormethan greift einige Formen von Kunststoffen, Gummi und Beschichtungen an.
Verdampfungswärme
28,82 kJ/mol A 25 ºC.
Oberflächenspannung
28.20 Dynas/cm bei 25 ºC.
Reaktivität
Das Dichlormethan reagiert stark mit aktiven Metallen wie Kalium, Natrium und Lithium. Reagiert beispielsweise mit starken Basen Kaliumbouthexid. Es ist unvereinbar mit ätzenden Substanzen, Oxidationsmitteln und chemisch aktiven Metallen.
Zusätzlich reagiert es mit flüssigem Sauerstoff in Natrium- und Kaliumlegierungen und Stickstofftetroxid. In Kontakt mit Wasser können Sie einige Edelstähle, Nickel, Kupfer und Eisen laufen lassen.
Anwendungen
Die meisten Verwendungen und Anwendungen des Dichlormethans basieren auf seinen Eigenschaften als Lösungsmittel. Aufgrund dieser Eigenschaft wird das Dichlormethan in Lebensmitteln, Transport, Medizinproduktionsindustrie usw. verwendet.
Lebensmittelverarbeitung
Das Dichlormethan wird in den entkoffeinierten Kaffeekörnern und Teeblättern verwendet. Es wird auch für die Hops -Extraktion für Bier, Getränke und andere Lebensmittelflaggen sowie für die Gewürzverarbeitung verwendet.
Pharmaindustrie
Das Dichlormethan wird für die Herstellung von Cephalosporin und Ampicillin zusätzlich zur Herstellung von Antibiotika, Steroiden und Vitaminen verwendet.
Fotografie
Es wird auch als Lösungsmittel für die Herstellung von Cellulose Triacetate (CTA) verwendet, die bei der Erstellung von Sicherheitsfilmen verwendet wird.
Elektronische Industrie
Es handelt.
Farben
Das Dichlormethan ist ein Lösungsmittel, das in Lack und in Farbabscheider vorkommt, um Lackien oder Überbeschichtung von Gemälden verschiedener Oberflächenarten zu beseitigen.
Transport
Es dient dazu, Metallteile und Oberflächen in Schienenausrüstung sowie in Flugzeugkomponenten zu entbinden.
Kann Ihnen dienen: destilliertes WasserAndere Verwendungen
Es wird als Sprühtreibmittel (Aerosole) und als Expansionsmittel für Polyurethanschaum verwendet. Es wird auch als Flüssigkeit in einigen Arten von Weihnachtslichtern verwendet.
Toxizität
Akute Effekte
Dichlormethaninhalation kann die Reizung der oberen Atemwege, Husten, Keuchen oder Luftmangel verursachen.
Es kann eine Hautrötung erzeugen und wenn die Verbindung eine lange Zeit bleibt, verursacht chemische Verbrennungen. In Kontakt mit den Augen erzeugt das Dichlormethan eine schwere Reizung, die sich auf eine Verbrennung erstrecken kann.
Darüber hinaus wirkt es als Neurotoxin, das visuelle, auditorische und psychomotorische Veränderungen erzeugt. Diese Effekte sind jedoch reversibel, um die Inhalation des Dichlormethans einzustellen.
Chronische Effekte
Das Dichlormethan kann das Zentralnervensystem beeinflussen und Kopfschmerzen, geistige Verwirrung, Übelkeit, Erbrechen und Gedächtnisverlust erzeugen.
Bei Tieren erzeugt es schädliche Auswirkungen auf die Leber, Nieren, das Zentralnervensystem und das Herz -Kreislauf -System.
Sobald die Karzinogenese bei Arbeitnehmern, die Dichlormethan ausgesetzt sind. Tierstudien haben jedoch einen Anstieg gezeigt, der auf Dichlormethan bei der Inzidenz von Leberkrebs und Lungen sowie gutartigen Tumoren der Brustdrüsen zurückzuführen ist.
Verweise
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. 5ta Auflage. Editorial Addison-Wesley Interamerikaner.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10th Auflage.). Wiley Plus.
- Nationales Zentrum für Biotechnologie Information. (2020). Dichlormethan. Pubchem -Datenbank., CID = 6344. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Wikipedia. (2020). Dichlormethan. Abgerufen von: in.Wikipedia.Org
- Brumer. (14. Juli 2018). Dichlormethan. Erholt von: Brumer.com
- MSDs online. (2019). Dichlormethan (Methylenchlorid) Gefahren und Sicherheitsinformationen. Abgerufen von: msdsonline.com
- EPA. (2000). Methylenchlorid (Dichlormethan). [PDF]. Erholt von: EPA.Regierung
- « Bestimmung von Asche -Methoden und Beispielen
- Südkorea -Kulturtraditionen, Bräuche, Gastronomie, Religion »

