Diphenylamin
- 1679
- 200
- René Riediger
Was ist das Demanin??
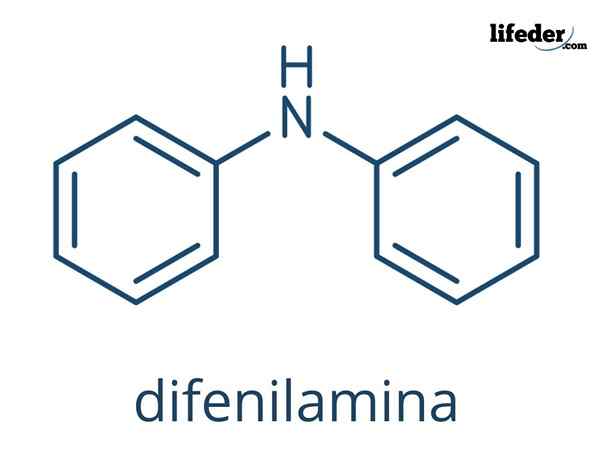
Der Diphenylamin Es ist eine organische Verbindung, deren chemische Formel ist (c6H5)2NH. Sein Name zeigt an, dass es sich um eine Amin sowie seine Formel handelt (-nh2). Andererseits bezieht sich der Begriff "Diffenil" auf das Vorhandensein zweier aromatischer Ringe, die mit Stickstoff verbunden sind. Folglich ist DeFilamin ein aromatischer Amin.
In der Welt der organischen Verbindungen hängt das aromatische Wort nicht unbedingt mit der Existenz seiner Gerüche zusammen, sondern mit Eigenschaften, die ihr chemisches Verhalten gegen bestimmte Arten definieren.

Im Falle von Diphenylamin ist seine Aromatie und die Tatsache, dass ihr Feststoff ein charakteristisches Aroma darstellt. Die Grundlage oder Mechanismen, die ihre chemischen Reaktionen regeln.
Seine chemische Struktur, Basizität, Aromatizität und intermolekulare Wechselwirkungen sind die Variablen, die für ihre Eigenschaften verantwortlich sind: Von der Farbe seiner Kristalle bis zur Anwendbarkeit als Antioxidationsmittel.
Chemische Struktur von Entfilamin

In den überlegenen Bildern sind die chemischen Strukturen des Diffenilamins dargestellt. Die schwarzen Kugeln entsprechen Kohlenstoffatomen, weiß bis Wasserstoffatomen und blau zum Stickstoffatom.
Der Unterschied zwischen beiden Bildern ist das Modell, wie sie das Molekül grafisch darstellen. Im niedrigeren unterstreicht es die Aromatizität der Ringe mit den in Schwarz geprägten Linien, und auch die flache Geometrie dieser Ringe wird gezeigt.
Keines der beiden Bilder zeigt das einsame Elektronenpaar, das nicht am Stickstoffatom geteilt wird. Diese Elektronen "gehen" durch das konjugierte π -System der Doppelbindungen in den Ringen. Dieses System bildet eine Art zirkulierende Wolke, die intermolekulare Wechselwirkungen ermöglicht. Das heißt, mit anderen Ringen aus einem anderen Molekül.
Es kann Ihnen dienen: Labor -Thermometer: Eigenschaften, wofür es, für die Verwendung, BeispieleDas obige bedeutet, dass das nicht stammende Stickstoffdrehmoment durch beide Ringe geht und in diesen seine elektronische Dichte verteilt und dann zu Stickstoff zurückkehren, um den Zyklus erneut zu wiederholen.
In diesem Prozess nimmt die Verfügbarkeit dieser Elektronen ab, was zu einer Abnahme der Basizität des Dipelamins führt (seine Tendenz, Elektronen als Lewis -Basis zu spenden).
Dipenylamin verwendet/Anwendungen
Diphenylamin ist ein Oxidationsmittel, das eine Reihe von Funktionen erfüllen kann, und darunter Folgendes:
- Während ihrer Lagerung erleben Äpfel und Birnen einen physiologischen Prozess namens Abkürzung, der sich auf die Produktion von konjugierten Trienos bezieht, was zu Hautschäden der Früchte führt. Dipenylaminwirkung ermöglicht es, die Speicherperiode zu erhöhen und die Früchteschäden auf 10 % dessen zu verringern, was in ihrer Abwesenheit beobachtet wird.
- Im Kampf gegen die Oxidation erweitern Diphenylamin und seine Derivate die Funktionen von Motoren, indem sie die Verdickung von gebrauchtem Öl vermeiden.
- Diphenylamin wird verwendet, um die Ozonwirkung in der Gummiherstellung zu begrenzen.
- Diphenylamin wird in der analytischen Chemie zur Nitraterkennung verwendet (nein3-), Chlorate (CLO3-) und andere Oxidationsmittel.
- Es ist ein Indikator, der bei Nitratvergiftungserkennungstests verwendet wird.
- Wenn die RNA für eine Stunde hydrolysiert wird, reagiert sie mit dem Entfilamin; Dies ermöglicht seine Quantifizierung.
- In der Veterinärmedizin wird Dipe -Pilamin topisch bei der Prävention und Behandlung der Manifestationen des Boreridwurms bei Zuchttieren verwendet.
- Einige der Duelaminderivate gehören zur Kategorie nichtsteroidaler entzündungshemmender Medikamente. Sie können auch pharmakologische und therapeutische Wirkungen wie antimikrobielles, Analgetika, Antikonvulsiva und Krebsaktivität haben.
Dipenylamin -Präparation
Natürlich wird das DeFilamin in der Zwiebel, im Koriantros, in den Blättern von grünem und schwarzem Tee und in den Muscheln der Zitrusfrüchte hergestellt. Synthetisch gibt es viele Routen, die zu dieser Verbindung führen, wie z. B.:
Thermische Desaminierung von Anilin
Es wird durch thermische Desaminierung von Anilin hergestellt (C6H5NH2) In Gegenwart oxidierender Katalysatoren.
Wenn Anilin in dieser Reaktion kein Sauerstoffatom in seine Struktur enthält, warum oxidieren Sie dann? Da der aromatische Ring eine Elektronenattraktorgruppe ist, im Gegensatz zum H -Atom, das seine niedrige elektronische Stickstoffdichte im Molekül spendet.
2 c6H5NH2 => (C5H5)2 NH+NH3
Außerdem kann Anilin mit Anilinhydrochloridsalz (C) reagieren6H5NH3+Cl-) unter einer Heizung von 230 ° C für zwanzig Stunden.
C6H5NH2 + C6H5NH3+Cl- => (C5H5)2 NH
Phänotiazinreaktion
Dipenylamin entsteht mehrere, die in Kombination mit unterschiedlichen Reagenzien abgeleitet wurden. Eines davon ist Phänotiazin, das mit Schwefel ein Vorläufer von Derivaten mit pharmazeutischer Wirkung ist.
(C6H5)2NH +2S => S (c6H4) Nh +h2S

Dipenylamineigenschaften
Dipenylamin ist ein weißer kristalline Feststoff. Es hat ein angenehmes Blumenaroma, ein Molekulargewicht 169,23 g/mol und eine Dichte von 1,2 g/ml.
Die Moleküle dieser Feststoffe interagieren durch Van-der-Waals.
Kann Ihnen dienen: Zinksulfid (Zns)Als aromatische Ringe belegen viel. Das Obige bewirkt, dass der Feststoff keinen sehr hohen Fusionspunkt (53 ºC) aufweist.
In flüssigem Zustand sind die Moleküle jedoch getrennter und die Wirksamkeit von Wasserstoffbrücken verbessert sich. Ebenso ist das Demanin relativ schwer und benötigt viel Wärme, um sich in eine Gasphase zu bewegen (302 ° C, sein Siedepunkt). Dies ist auch teilweise auf das Gewicht und die Wechselwirkungen der aromatischen Ringe zurückzuführen.
Löslichkeit und Basizität
Es ist sehr unlöslich in Wasser (0,03 g/100 g Wasser) aufgrund des hydrophoben Charakters seiner aromatischen Ringe. Stattdessen ist es in organischen Lösungsmitteln wie Benzol, Kohlenstofftetrachlorid (CCL) sehr löslich4), Aceton, Ethanol, Pyridin, Essigsäure usw.
Seine Säurekonstante (PKA) beträgt 0,79, was sich auf die Säure ihrer konjugierten Säure bezieht (C6H5NH3+). Das zu Stickstoff zugefügte Proton neigt dazu, sich zu trennen, da das Elektronenpaar, mit dem es verbunden ist, durch die aromatischen Ringe gehen kann. Somit, hohe Instabilität c6H5NH3+ Es spiegelt die niedrige Basizität von Diffenilamin wider.
Verweise
- Die Lubrizol Corporation. (2018). Diphenylamin -Antioxidantien. Von Lubrizol geborgen.com
- Arun Kumar Mishra, Arvind Kumar. (2017). Pharmakologische Anwendungen von Diphenylamin und seinem Derivat als starke bioaktive Verbindung: eine Übersicht. Strom bioaktive Verbindungen, Volumen 13.
- Primchem. (2015-2016). Herstellung von Diphenylamin. Aus dem Imprimchem geborgen.com
- Pubchem. (2018). Diphenylamin. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Wikipedia. (2018). Diphenylamin. Abgerufen von.Wikipedia.Org

