Unterschiede zwischen organischen und anorganischen Verbindungen

- 4980
- 504
- Ivan Pressler
Der Unterschiede zwischen organischen und anorganischen Verbindungen Sie sind nicht immer einfach, und sie befolgen auch nicht eine unveränderliche Regel, da es in Bezug auf die Chemie Symphine von Ausnahmen gibt, die dem Vorwissen widersprechen oder in Frage stellen. Es gibt jedoch Merkmale, die es ermöglichen, unter vielen Verbindungen zu erkennen, die anorganisch sind oder nicht.
Die organische Chemie ist per Definition die Studie, die alle Zweige der Kohlenstoffchemie umfasst. Daher ist es logisch zu glauben, dass ihre Skelette aus Kohlenstoffatomen bestehen. Andererseits bestehen anorganisch.
Lebewesen sind auf all ihren Waagen und Ausdrücken praktisch aus Kohlenstoff und anderen Heteroátomos hergestellt (H, O, N, P, S usw.). Das ganze Grün, das die Kruste der Erde abdeckt, sowie die Kreaturen, die darauf gehen, sind Beispiele für vermischte organische Verbindungen, die komplex und dynamisch sind.
Andererseits finden wir die Erde und in den Bergen reiche Mineralkörper in Zusammensetzung und geometrischen Formen, die in ihrer überwiegenden Mehrheit anorganische Verbindungen sind. Letztere definieren auch fast ausschließlich die Atmosphäre, die wir atmen, und die Ozeane, Flüsse und Seen.
Organische Verbindungen | Anorganische Verbindungen | |
Atome, die es komponieren | Sie enthalten Kohlenstoffatome. | Sie bestehen aus anderen Elementen als Kohlenstoff. |
Sie sind Teil von .. | Sind Teil der Lebewesen. | Sie sind Teil von Inertwesen. |
Quellen, in denen sie sind | Sie sind in natürlichen Quellen weniger reichlich vorhanden. | Sie sind in natürlichen Quellen häufiger. |
Arten von Verbindungen | Sie sind normalerweise molekular. | Sie sind normalerweise ionisch. |
Arten von Links | Kovalente Links. | Ionische Verbindungen. |
Molmassen | Größere Molmassen. | Untere Molmassen. |
Diversität | Sie sind weniger vielfältig. | Sie sind vielfältigere Elemente. |
Fusion und Siedepunkte | Kleinere Fusion- und Siedepunkte. | Höhere Fusions- und Kochenpunkte. |
Hauptunterschiede zwischen organischen und anorganischen Verbindungen
Anorganische Verbindungen werden aus den natürlichen Quellen reichhaltiger erhalten als die von anorganischen Verbindungen
 Zuckerkristalle (rechts) und Salz (links) im Mikroskop zu sehen. Quelle: Oleg Panichev [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Zuckerkristalle (rechts) und Salz (links) im Mikroskop zu sehen. Quelle: Oleg Panichev [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Obwohl es Ausnahmen geben kann, werden anorganische Verbindungen normalerweise aus natürlichen Quellen reichhaltiger als die für organische Verbindungen erhalten. Dieser erste Unterschied führt zu einer indirekten Aussage: Anorganische Verbindungen sind häufiger (auf der Erde und im Kosmos) als organische Verbindungen.
Natürlich überwiegen in einer Ölstelle, Kohlenwasserstoffe und verwandte Prädiominat, die organischen Verbindungen sind.
Wenn Sie in den Abschnitt zurückkehren, kann es als Beispiel am Zuckersalz erwähnt werden. Die Zuckerkristalle (robuster und facettiert) und Salz sind oben gezeigt (kleiner und abgerundet).
Der Zucker wird nach einer Reihe von Prozessen aus Zuckerrohrplantagen (in sonnigen oder tropischen Regionen) und Zuckerrüben (in kalten Regionen oder zu Beginn des Winters oder Herbstes) erhalten. Beide sind natürliche und erneuerbare Rohstoffe, die bis zu ihrer richtigen Ernte angebaut werden.
Kann Ihnen dienen: Standardisierung von LösungenIn der Zwischenzeit stammt Salz aus einer viel häufig vorhandenen Quelle: dem Meer oder Seen und Salzen wie dem Halita Mineral (NaCl). Wenn alle Zuckerrohr- und Zuckerrüben gesammelt würden, konnten sie niemals mit den natürlichen Salzreserven übereinstimmen.
Anorganische Kristalle sind normalerweise ionisch, während organische Kristalle tendenziell molekular sind
Wenn wir das Zucker-Exal-Paar als Beispiel erneut einnehmen. Die Zuckerkristalle sind molekular, da sie durch Saccharose und ihre intermolekularen Wasserstoffbrücken definiert werden.
In der Zwischenzeit bilden Salzkristalle ein na Ion -Netzwerk+ und Cl-, die eine Kubikstruktur definieren, die sich auf den Gesichtern konzentriert (FCC).
Der zentrale Punkt ist, dass anorganische Verbindungen normalerweise ionische Kristalle bilden (oder zumindest einen hohen ionischen Charakter besitzen). Es gibt jedoch mehrere Ausnahmen, wie z. B. Co -Kristalle2, H2S, so2 und andere anorganische Gase, die bei niedrigen Temperaturen und hohen Drücken festigen und auch molekular sind.
Wasser stellt die wichtigste Ausnahme von diesem Punkt dar: Eis ist ein anorganischer und molekularer Kristall.
 Die wenigen Schnee oder Eis sind Wasserkristalle, hervorragende Beispiele für anorganische molekulare Kristalle. Quelle: Sieverchar de Pixabay.
Die wenigen Schnee oder Eis sind Wasserkristalle, hervorragende Beispiele für anorganische molekulare Kristalle. Quelle: Sieverchar de Pixabay. Mineralien sind im Wesentlichen anorganische Verbindungen, und ihre Kristalle sind daher überwiegend ionischer Natur. Aus diesem Grund wird dieser zweite Punkt für ein breites Spektrum anorganischer Verbindungen, einschließlich Salze, Sulfide, Oxiden, Telluros usw., als gültig angesehen.
Die Art der Verbindung, die in organischen Verbindungen regiert, ist kovalent
Dieselben Zucker- und Salzkristalle hinterlassen etwas Frage: Ersteres enthalten kovalente (gerichtete) Verbindungen, während die letzteren ionische (nicht leitende) Verbindungen (nicht leitend) aufweisen.
Dieser Punkt korreliert direkt mit dem zweiten: Ein molekularer Kristall muss notwendigerweise mehrere kovalente Bindungen aufweisen (teilen Sie ein paar Elektronen zwischen zwei Atomen).
Auch hier stellen organische Salze bestimmte Ausnahmen fest, da sie auch einen stark ionischen Charakter haben; Zum Beispiel Natriumbenzoat (C6H5Pata) ist ein organisches Salz, aber in Benzoat und seinem aromatischen Ring gibt es kovalente Bindungen. Trotzdem wird gesagt, dass ihre Kristalle angesichts der elektrostatischen Wechselwirkung ionisch sind: C6H5Gurren- N / A+.
In organischen Verbindungen dominieren kovalente Bindungen zwischen Kohlenstoffatomen
Oder was ist das Gleiche zu sagen: Organische Verbindungen bestehen aus kohlensäurehalten Skeletten. In ihnen gibt es mehr als eine C-C- oder C-H-Bindung, und dieses Skelett kann linear, erregt oder verzweigt sein und variiert im Grad ihrer Unsättigung und der Art des Substituenten (Heteroaátomos oder funktionelle Gruppen). In Zucker, C-C-, C-H- und C-OH-Verbindungen gibt es zuhauf.
Es kann Ihnen dienen: Reduktionsmittel: Konzept, die stärksten BeispieleLassen Sie uns als Beispiel den CO, Ch2Och2 und h2C2ENTWEDER4. Welche dieser drei Verbindungen sind anorganisch?
In Ch2Och2 (Ethylendioxid) Es gibt vier C-H-Bindungen und zwei C-O-Verbindungen, während in H2C2ENTWEDER4 (Oxalsäure) Es gibt einen C-C, zwei c-oh und zwei c = o. Die Struktur von h2C2ENTWEDER4 Es kann als Hooc-CooH geschrieben werden (zwei verknüpfte Carboxylgruppen). In der Zwischenzeit besteht der CO aus einem Molekül, das normalerweise mit einer Hybridbindung zwischen C = O und C≡O dargestellt wird.
Da im CO (Kohlenmonoxid) nur ein Kohlenstoffatom mit einem Sauerstoff verbunden ist, ist dieses Gas anorganisch; Die anderen Verbindungen sind organisch.
Organische Verbindungen haben normalerweise größere Molmassen
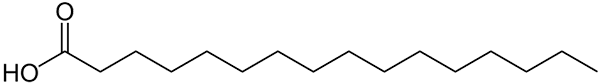 Struktur mit Palmitinsäurelinien dargestellt. Die große Sache, die mit kleineren anorganischen Verbindungen oder dem Formelgewicht seiner Salze verglichen wird, kann bemerkt werden. Quelle: Wolfgang Schaefer [Public Domain]
Struktur mit Palmitinsäurelinien dargestellt. Die große Sache, die mit kleineren anorganischen Verbindungen oder dem Formelgewicht seiner Salze verglichen wird, kann bemerkt werden. Quelle: Wolfgang Schaefer [Public Domain] Auch hier gibt es zahlreiche Ausnahmen von diesen Regeln, aber in der Regel haben organische Verbindungen aufgrund ihres kohlensäurehaltigen Skeletts tendenziell größere Molmassen.
Zum Beispiel sind die Molaren der obigen Verbindungen: 28 g/mol (co), 90 g/mol (h)2C2ENTWEDER4) und 60 g/mol (wählen2Och2). Natürlich die CS2 (Kohlenstoffdisulfid), anorganische Verbindung und deren Molmasse 76 g/mol ist, "wiegt" mehr als Cho2Och2.
Aber was ist mit Fetten oder Fettsäuren? Von Biomolekülen wie DNA oder Proteinen? Oder aus ausgedehnten linearen Kohlenwasserstoffen? Oder Asphalten? Seine Molmassen überschreiten 100 g/mol leicht. Palmitinsäure (oberes Bild) hat beispielsweise einen 256 g/mol -Molaren Teig.
Organische Verbindungen sind in der Anzahl häufiger
Einige anorganische Verbindungen, die als Koordinationskomplexe bezeichnet werden, zeigen Isomeía. Dies ist jedoch weniger vielfältig im Vergleich zu organischen Isomerien.
Auch wenn wir alle Salze, Oxide (metallisch und nicht metallisch), Sulfide, Telururos, Carbide, Hydride, Nitride usw. hinzufügen, usw., Wir würden uns vielleicht nicht versammeln, vielleicht nicht einmal die Hälfte der organischen Verbindungen, die in der Natur existieren können. Daher sind organische Verbindungen häufiger in der Anzahl und reicher Strukturen.
Anorganische Verbindungen sind elementar vielfältiger
Nach der Elementarvielfalt sind anorganische Verbindungen jedoch unterschiedlicher. Weil? Denn mit der Periodenzüchter in der Hand können Sie jede Art von anorganischer Verbindung bauen; Während eine organische Verbindung nur auf die Elemente begrenzt ist: C, H, O, P, S, N und X (Halogenen).
Wir haben viele Metalle (Alkalin, Alkaliner, Übergang, Lanthanide, Actiniden, die von Block P) und unendliche Möglichkeiten, sie mit mehreren Anionen (gewöhnliche anorganische) zu kombinieren. wie: co32- (Carbonate), CL- (Chloride), p3- (Phosphuros) oder2- (Oxide), OH- (Hydroxides), also42- (Sulfate), CN- (Cyanides), SCN- (Tiocianaten) und vieles mehr.
Beachten Sie, dass CN -Anionen- und scn- Sie scheinen organisch zu sein, aber sie sind tatsächlich anorganisch. Eine weitere Verwirrung ist das Oxalatanion, C2ENTWEDER42-, das ist organisch und nicht -inorganisch.
Kann Ihnen dienen: Diagonale RegelAnorganische Verbindungen haben höhere Fusions- und Siedepunkte
Auch hier gibt es mehrere Ausnahmen von dieser Regel, da alles davon abhängt, welches Verbindungspaar verglichen wird. Wenn Sie sich jedoch an anorganische und organische Salze halten, haben erstere normalerweise größere Fusions- und Siedepunkte als die letzteren.
Hier finden wir einen weiteren impliziten Punkt: Bio -Salze sind anfällig für Zersetzung, da die Wärme seine kovalenten Bindungen durchbricht. Trotzdem vergleichen wir den Calciumtartrato Par (CAC)4H4ENTWEDER6) und Calciumcarbonat (Caco3). Der CAC4H4ENTWEDER6 Es zersetzt sich bei 600 ° C, während der Kako3 Es schmilzt bei 825 ° C.
Und dass der Kako3 ist weit davon entfernt, eines der Salze mit den höchsten Schmelzpunkten zu sein, wie in den Fällen des CAC2 (2160 ºC) und CAS2 (2525 ºC): Carburo bzw. Calciumsulfid.
Organische Verbindungen sind im Universum seltener
Die einfachsten und primitivsten organischen Verbindungen wie Methan, Cho4, Harnstoff, CO (NH2)2, oder die Aminosäureglycina, NH2CH2COOH sind sehr seltene Arten im Kosmos im Vergleich zu Ammoniak, Kohlendioxid, Titanoxiden, Kohle usw. Im Universum werden sogar die Vorläufermaterialien des Lebens nicht oft erkannt.
Organische Verbindungen unterstützen das Leben in viel größerem Maße als anorganisch
 Die Schale eines Morrokoy besteht aus einer Mischung aus Knochen, die von Keratin bedeckt sind und aus einer anorganischen Matrix (Hydroxylapatit und verwandten Mineralien) und organischen (Kollagen, Knorpel und Nerven) bestehen, die bestehen. Quelle: Morrocoy_ (Geochelone_Carbonary).JPG: Die Fotografie.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Die Schale eines Morrokoy besteht aus einer Mischung aus Knochen, die von Keratin bedeckt sind und aus einer anorganischen Matrix (Hydroxylapatit und verwandten Mineralien) und organischen (Kollagen, Knorpel und Nerven) bestehen, die bestehen. Quelle: Morrocoy_ (Geochelone_Carbonary).JPG: Die Fotografie.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Organische Kohlenstoffchemie, im Verständnis von Stoffwechselprozessen angewendet, wird zu Biochemie (und aus der Sicht von Metallkationen in bioinorganischer Sicht).
Organische Verbindungen sind der Eckpfeiler des Lebens (wie das Morrokoy des oberen Bildes) dank der C-C-Verbindungen und des riesigen Konglomerats von Strukturen, die sich aus diesen Verbindungen ergeben, und zu seiner Wechselwirkung mit Kristallen anorganischer Salze.
Zurück zum Zuckersalzpaar sind die natürlichen Zuckerquellen am Leben: Sie sind Pflanzen, die sich entwickeln und sterben; Aber mit den Salzquellen passiert es nicht dasselbe: Die Meere oder die Kochsalzlösung sind lebendig (in physiologischer Sinne).
Pflanzen und Tiere synthetisieren endlose organische Verbindungen, die ein umfangreiches Spektrum von Naturprodukten integrieren (Vitamine, Enzyme, Hormone, Fette, Farbstoffe usw.).
Wir können jedoch nicht die Tatsache auslassen, dass Wasser das Lösungsmittel des Lebens ist (und anorganisch); Auch dieser Sauerstoff ist für die Zellatmung nicht unverzichtbar (ohne Metall -Cofaktoren, die nicht anorganische Verbindungen, sondern Kationen sind). Daher spielt anorganische auch eine entscheidende Rolle bei der Definition des Lebens.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. Amine. (10. Ausgabe.). Wiley Plus.
- Helmestine, Anne Marie, ph.D. (3. Juli 2019). Der Unterschied zwischen organisch und anorganisch. Erholt von: thoughtco.com
- Texas Education Agency. (2019). Bio oder anorganisch? Erholt von: Texasgateway.Org
- Saccharose. (S.F.). Wie Zucker gemacht wird: Eine Einführung. Erholt von: Sucrosa.com
- Wikipedia. (2019). Liste der anorganischen Verbindungen. Abgerufen von: in.Wikipedia.Org
- « Unterschiede zwischen Geschwindigkeit und Geschwindigkeit (mit Beispielen)
- 10 Dynamik der emotionalen Intelligenz für Kinder und Erwachsene »

