Dimethylamin ((CH3) 2NH) Struktur, Eigenschaften, Verwendung, Risiken
- 1918
- 592
- Frederike Birkemeyer
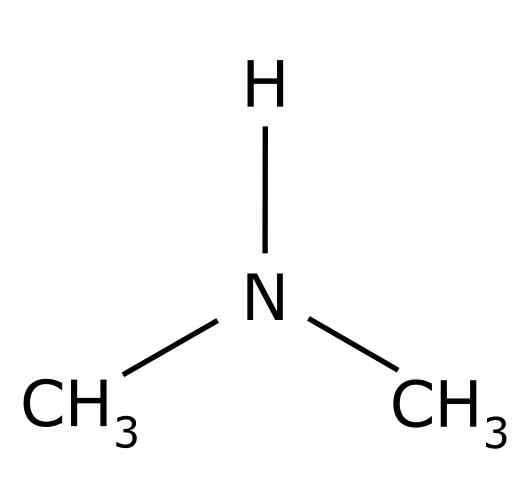
Der Dimethylamin Es handelt3 Zu einer -nh -Gruppe vereint. Seine chemische Formel ist (Cho3)2NH. Es ist ein farbloses Gas. Wenn ein Geruch von Fischen in der Luft bei niedrigen Konzentrationen wahrgenommen wird. Wenn es sich jedoch in hoher Konzentration befindet, hat es einen Geruch nach Ammoniak NH3.
Dimethylamin ist in Pflanzen und Tieren vorhanden. Es wird angenommen, dass beim Menschen aus der Zersetzung bestimmter Enzyme, aber auch aus der Aufnahme einiger Lebensmittel wie Fisch kommt. Wenn sich Dimethylamingas in Wasser löst, bildet es sehr alkalische und korrosive Lösungen.
 Dimethylamin. Ring0 [Public Domain]. Quelle: Wikimedia Commons.
Dimethylamin. Ring0 [Public Domain]. Quelle: Wikimedia Commons. Es verfügt über verschiedene industrielle Verwendungszwecke wie die Herstellung von Lösungsmitteln, um die Vulkanisierung von Gummi zu beschleunigen.
Dimetilamin ist ein sehr brennbares Gas. Die Behälter, die es enthalten, sollte nicht Wärme oder Feuer ausgesetzt sein, wie sie ausnutzen können. Darüber hinaus sind ihre Dämpfe irritierende Augen, Haut und Atemwege.
Es ist eine Verbindung, die Teil der atmosphärischen Aerosole sein kann, dh von sehr dünnen Tröpfchen in der Atmosphäre.
[TOC]
Struktur
Dimetilamin ist eine sekundäre aliphatische Amin. Dies bedeutet, dass Stickstoffsubstituenten (n) aliphatisch sind (-ch3), was bedeutet, dass sie nicht aromatisch sind und dass sie zwei sind. Daher gibt es zwei Methyl -ch3 Stickstoff der Vereinigte Sticke, das auch einen Wasserstoff hat (H).
Im Dimethylaminmolekül hat Stickstoff (N) ein Paar freier Elektronen, dh ein paar Elektronen, die keinem anderen Atom vereint sind.
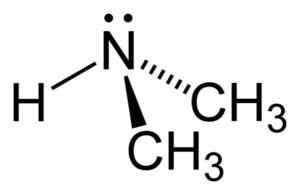 Struktur von Dimethylamin. Autor: Benjah-BMM27. Quelle: Wikimedia Commons.
Struktur von Dimethylamin. Autor: Benjah-BMM27. Quelle: Wikimedia Commons. Nomenklatur
- Dimethylamin
- N, n-Dimethylamin
- N-Methylmetanamin
- DMA (Akronym für DI-Methyl-Amin).
Eigenschaften
Körperlicher Status
Farbloses Gas.
Molekulargewicht
45,08 g/mol
Schmelzpunkt
-93 ºC
Siedepunkt
7.3 ºC
Flammpunkt
-6,69 ºC (Methode für geschlossene Tassen).
Selbstdirektionstemperatur
400 ° C
Kann Ihnen dienen: Gesetz von mehreren ProportionenDichte
Flüssigkeit = 0,6804 g/cm3 A 0 ºC.
Dampf = 1,6 (relative Dichte in Bezug auf Luft, Luft = 1).
Löslichkeit
Sehr löslich in Wasser: 163 g/100 g Wasser bei 40 ° C. Löslich in Ethanol und Ethylether.
pH
Wässrige Dimethylaminlösungen sind stark alkalisch.
Dissoziationskonstante
KB = 5,4 x 10-4
PkZu von konjugierten Säure = 10.732 bis 25 ° C. Konjugatsäure ist das Dimethylamoniumion: (Cho3) Nh2+
Chemische Eigenschaften
Flüssiges Dimethylamin kann einige Kunststoffe, Reifen und Beschichtungen angreifen.
Beim Auflösen in Wasser nimmt das stickstofffreie Elektronenpaar (N) ein Proton (H)+) Wasser, ein oh frei lassen-, So bildet es sehr alkalische und korrosive Lösungen:
Dimethylamin + Wasser → Dimethylamoniumion + Hydroxylionion
(CH3)2NH + H2O → (wählen Sie3)2NH2+ + Oh-
Mit Salpetersäure wird ein Nitratsalz erhalten, dh Dimethyla -Amotylamoniumnitrat:
Dimethylamin + Salpetersäure → Dimethylamoniumnitrat
(CH3)2NH +Hno3 → (Ch3)2NH2+NEIN3-
Andere Eigenschaften
Wenn in niedriger Luftkonzentration einen Geruch ähnlich wie Fische hat, während es in hohen Konzentrationen nach Ammoniak riecht (NH3).
Biochemische Reaktionen
Im Organismus kann Dimethylamin unter schwach sauren Bedingungen Nitrillare leiden, um Dimethylnitrosamin eine Karzinogenverbindung zu ergeben (CH3)2N-nr.
Dimetlnitrosaminbildung tritt aus Dimethylamin und Nitrit (Natriumnitrit) im Magen (ein pH 5-6) durch Wirkung der im Magen-Darm-Trakt existierenden Bakterien auf. Natriumnitrit ist in einigen Lebensmitteln vorhanden.
Dimethylamin + Natriumnitrit → Dimethylnitrosamin + Natriumhydroxid
(CH3)2NH + Nano2 → (Ch3)2N-No + Naoh
Erhalten
Dimetilamin wird kommerziell durch Reagieren von Methanol hergestellt (wählen3OH) mit Ammoniak (NH3) bei 350-450 ° C in Gegenwart eines Kieselsäure-Alumina-Katalysators (SiO2/Zum2ENTWEDER3).
2 Ch3OH + NH3 → (Ch3)2NH + 2 h2ENTWEDER
Da Monomethylamin und Trimethylamin ebenfalls erzeugt werden, wird eine Reinigung in einer Reihe von vier bis fünf Destillationssäulen durchgeführt.
Präsenz in der Natur
Dimethylamin kommt in Pflanzen und Tieren vor. Es ist auch natürlich und reichlich im menschlichen Urin vorhanden.
Es kann Ihnen dienen: Epoxid: Nomenklatur, erhalten, Anwendungen, BeispieleEs wird geschätzt, dass sein Vorhandensein beim Menschen auf die Tatsache zurückzuführen ist, dass bestimmte Arten von Darmbakterien aus einigen Verbindungen in Lebensmitteln hergestellt werden.
Einige dieser Verbindungen sind der Hügel (Verbindung, der mit der Vitaminengruppe B assoziiert ist) und Trimethylaminoxid. Es wird auch angenommen, dass es von einem Enzyminhibitor von Stickoxid (NO) stammt, der im Körper gebildet wird.
Bestimmte Informationsquellen deuten darauf hin, dass die Zunahme von Dimethylamin im Urin durch die Aufnahme von Fischen und Früchten des Meeres verursacht wird, bei denen wichtige Werte erhalten werden, wenn sie Tintenfisch, Seehecht, Sardinen, Schwertfische, Kabeljau, Fisch und Linie essen.
 Das Essen von Fisch könnte den Dimethylaminspiegel im Urin erhöhen. Autor: Anna Sulencha. Quelle: Pixabay.
Das Essen von Fisch könnte den Dimethylaminspiegel im Urin erhöhen. Autor: Anna Sulencha. Quelle: Pixabay. Patienten mit überschüssigem Dimethylamin
Es wird angenommen, dass Dimethylamin ein urämisches Toxin ist, dh eine Substanz, die Schäden verursachen kann, wenn seine Konzentration im Urin erhöht wird. Tatsächlich wurden bei Patienten mit Nierenerkrankungen im Endstadium sehr hohe Dimethylaminspiegel beobachtet.
Es wird angenommen, dass bei diesen Patienten möglicherweise Überbevölkerung von Darmbakterien vorhanden sein kann, die es produzieren könnten.
Anwendungen
DMA oder DMA wird verwendet für:
- Herstellung anderer Verbindungen.
- Produktion von Dimethylformamid und Dimethylacetamid -Lösungsmitteln.
- Beschleunigen Sie die Vulkanisierung bestimmter Zahnfleisch.
- Beseitigen Sie Haarhaare während des Geräts.
- Als Antioxidans für Lösungsmittel wirken.
- Als Mineralflotationsmittel dienen.
- Korrosion und als Anti -Sniff -Mittel hemmen.
- Funktion als Tensid.
- Seifen und Waschmittel machen.
- Fungieren als Chemiker in Textilien.
- Funktionieren Sie als Anti -Zeugung in Kraftstoffen und als Gasstabilisator.
- Farbstoffe vorbereiten.
- Säuregase absorbieren.
- Als Pestizide und Raketen dienen.
- Teil von Agenten für die Wasseraufbereitung sein.
- Fungieren als Fungizid in agrochemischen Produkten.
- Bereits abgebrochene Verwendungen wie das Anziehen und Ausrotten von Gorgjos oder Insekten, die Baumwolle angreifen.
 Baumwollpflanze. Autor: Isaa KC. Quelle: Pixabay.
Baumwollpflanze. Autor: Isaa KC. Quelle: Pixabay.  In der Vergangenheit wurden die Insekten, die Baumwollpflanzen angreifen, mit Dimethylamin eliminiert. Marvinbikolano [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
In der Vergangenheit wurden die Insekten, die Baumwollpflanzen angreifen, mit Dimethylamin eliminiert. Marvinbikolano [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. Risiken
Dimetilamin -Dämpfe sind irritierende Haut, Augen und Atemwege.
Kann Ihnen dienen: anorganische VerbindungenWenn Sie in flüssiger Form mit der Haut in Kontakt kommen. Die Inhalation hat nachteilige gesundheitliche Auswirkungen.
DMA -Gas ist ätzend und kann korrosive wässrige Lösungen bilden. Ihre wässrigen Lösungen können brennbar werden, es sei denn, sie sind ziemlich verdünnt.
Gas -verdrängter Dimethylamin wird leicht entzündet, indem giftige Stickoxide produziert werden (neinX).
Wenn der Behälter, der dieses Gas enthält, intensiver Wärme oder Wärme ausgesetzt ist, kann es explodieren.
Einfluss der DMA in der Atmosphäre
Atmosphärisches Aerosol (sehr kleine Tröpfchen der Mischung aus natürlichen Verbindungen und/oder Schadstoffen in der Atmosphäre) haben einen tiefen Einfluss auf die globale Klima und die Luftqualität in den verschiedenen Regionen der Welt.
Die Bildung neuer Aerosolpartikel ist noch nicht vollständig verstanden.
Es wird geschätzt, dass Dimethylamin zusammen mit anderen Verbindungen bei der Bildung dieser Partikel beteiligt ist, was von der Fläche starker DMA -Emissionen zu abhängen scheint.
Zum Beispiel gibt es in Industriegebieten eine größere Konzentration als in landwirtschaftlichen Gebieten, und dies kann die Art und Weise beeinflussen, wie die DMA teilnimmt.
Es ist zu beachten, dass nach Ansicht einiger Wissenschaftler das Verbrennen von Pflanzenmaterial, das Glyphosat enthält.
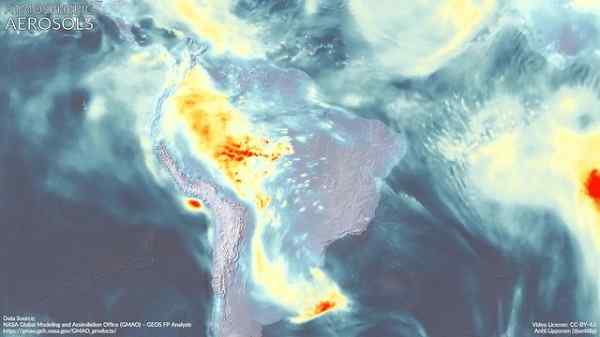 Atmosphärische Aerosole auf Südamerika. Dimetilamin könnte zu seiner Bildung beitragen. Marvinbikolano [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Atmosphärische Aerosole auf Südamerika. Dimetilamin könnte zu seiner Bildung beitragen. Marvinbikolano [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Dimethylamin. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Vierte Edition. John Wiley & Söhne.
- Morrison, r.T. und Boyd, r.N. (2002). Organische Chemie. 6. Ausgabe. Prentice-Hall.
- Windholz, m. et al. (Herausgeber) (1983). Der Merck Index. Eine Enyclopedia aus Chemikalien, Medikamenten und biologischen. Zehnte Ausgabe. Merck & co., Inc.
- Abramowitz, m.K. et al. (2010). Die Pathophysiologie der URMIA. Aliphatische Amine. Bei chronischen Nierenerkrankungen, Dialyse und Transplantation (dritte Ausgabe). Von Scientedirect erholt.com.
- Li, h. et al. (2019). Einfluss atmosphärischer Zustände auf Schwefelsäure-Dimethylamin-Ammonia-basierte neue Partikelbildung. Chospher 2019; 245: 125554. NCBI erholte sich.NLM.NIH.Regierung.
- Mackie, J.C. und Kennedy und.M. (2019). Pyrolyse von Glyphosat und Liedern giftige Produkte. Umfeld. Sci. Technol. 2019: 53 (23): 13742-13747. NCBI erholte sich.NLM.NIH.Regierung.

