Dimethylanylinstruktur, Eigenschaften, Synthese, verwendet
- 2141
- 94
- Luca Holdt
Der Dimethylanylin o Dimetilphenyllamin ist eine organische Verbindung, die durch einen Benzolring mit einer Aminogruppe gebildet wird, die durch zwei Methylgruppen ersetzt wird. Seine chemische Formel ist c8HelfN.
Es ist auch als N, N-Dimethylanylin bekannt, da es ein Derivat von Anylin ist. Dies macht es zu einem tertiären Amin.
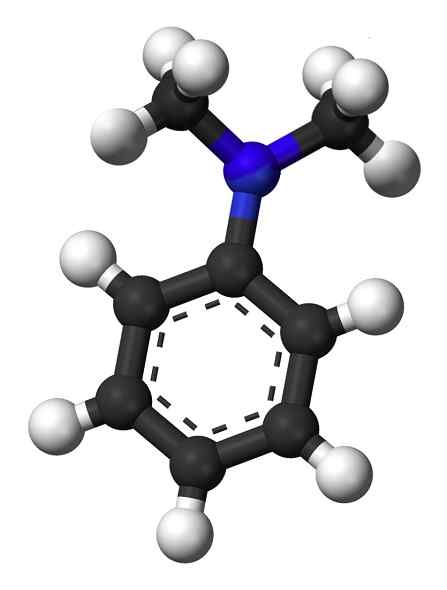
 Struktur von N, N-Dimethylanylin. Kein maschinenlesbarer Autor zur Verfügung gestellt. Mysid nahm an (basierend auf Urheberrechtsansprüchen). [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikipedia Commons.
Struktur von N, N-Dimethylanylin. Kein maschinenlesbarer Autor zur Verfügung gestellt. Mysid nahm an (basierend auf Urheberrechtsansprüchen). [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikipedia Commons. N, N-Dimethylanylin ist eine hellgelb bis braune ölige Flüssigkeit mit dem charakteristischen Geruch von Aminen. Es handelt. Wenn es der Luft ausgesetzt ist, wird es braun.
Es wird zur Herstellung von Farbstoffen für Gemälde verwendet. Es wird auch als Aktivator von Polymerisationskatalysatoren und in Gemischen zur Bildaufzeichnung verwendet. Wiederum wurde es in der Synthese von antibakteriellen Verbindungen oder Antibiotika als bestimmte Penicillin -abgeleitete Cephalosporine verwendet. N, N-Dimethylanylin ist auch eine Grundlage für die Erlangung anderer chemischer Verbindungen.
Es ist eine brennbare Flüssigkeit und wenn sie erhitzt wird, bis die Zersetzung giftige Dämpfe abgibt. Die akute Exposition des Menschen gegenüber N, N-Dimethylanylin kann zu negativen Wirkungen wie Kopfschmerzen, Schwindel, Abnahme des Blutsauerstoffgens und der bläulichen Hautfärbung führen, unter anderem Symptome.
[TOC]
Struktur
Die folgende Abbildung zeigt die räumliche Struktur des n-n-Dimethylanylins:
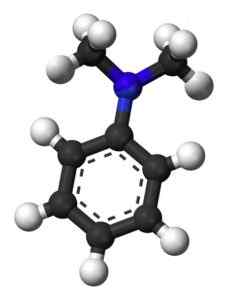 Räumliche Struktur von n, n-dimethylanylin. Esquilo [Public Domain]. Quelle: Wikipedia Commons.
Räumliche Struktur von n, n-dimethylanylin. Esquilo [Public Domain]. Quelle: Wikipedia Commons. Nomenklatur
- N, N-Dimethylanylin
- Dimethylanylin
- Dimethylphenyllamin
- N, N-Dimethylbencenamin
N wird im Namen platziert, um anzuzeigen, dass die beiden Methylgruppen (-ch3) sind an Stickstoff (n) und nicht am Benncénico -Ring befestigt.
Eigenschaften
Körperlicher Status
Blass bis braune Flüssigkeit.
Molekulargewicht
121,18 g/mol.
Kann Ihnen dienen: Anion: Training, Eigenschaften und TypenSchmelzpunkt
3 ºC.
Siedepunkt
194 ºC.
Flammpunkt
63 ºC (Methode für geschlossene Tassen). Es ist die Mindesttemperatur, bei der Dämpfe eingeschaltet werden können, wenn eine Flamme weitergegeben wird.
Dampfdruck
0,70 mm Hg bei 25 ºC.
Selbstdirektionstemperatur
371 ºC. Es ist die Mindesttemperatur bei spontan brennendem atmosphärischem Druck ohne externe Wärme- oder Flammequelle.
Dichte
0,9537 g/cm3 bei 20 ºC.
Brechungsindex
1.5582 bis 20 ° C.
Löslichkeit
In Wasser ist es sehr wenig löslich: 1.454 mg/l a 25 ºC.
Frei löslich in Alkohol, Chloroform und Äther. Löslich in Aceton, Benzol und Sauerstoff- und chlorierten Lösungsmitteln.
Basizitätskonstante
KB 11.7, was die Leichtigkeit anzeigt, mit der diese Verbindung ein Wasserstoffionen von Wasser akzeptiert.
Chemische Eigenschaften
N, N-Dimethylanylin ist eine Grundverbindung. Reagiert mit Essigsäure, um Acetat von N, N-Dimetilanilinio zu ergeben.
Die -n -Gruppe (wählen Sie3)2 N-dimethylanylin ist ein starker aromatischer Substitutionsaktivator in der Position für des Benzolrings.
Reagiert mit Natriumnitrit (Nano2) In Gegenwart von Salzsäure (HCl), die p-nitroso-n, n-dimethylanylin bildet. Auch mit Liegensäure erzeugt den gleichen zusammengesetzten Nitrosado in Position für.
Bei der Reaktion des N-N-Dimetilanilin mit dem Benzezoniumchlorid in einem sanft sauren Medium gibt es einen azokomponierten AR-N = N-AR-Typ, wobei AR eine aromatische Gruppe ist. Die Moleküle mit Azogruppen sind stark gefärbte Verbindungen.
Risiken
Wenn er auf seine Zersetzung erhitzt wirdX.
Es ist eine brennbare Flüssigkeit.
Es zersetzt sich langsam in Wasser, das Sonnenlicht ausgesetzt ist. Es ist nicht biologisch angelegt.
Es wird aus feuchten Boden und Wasseroberflächen verflüchtigt. Verdampfe trockenen Boden nicht und bewege dich durch das. Sammelt sich nicht in Fischen an.
Kann Ihnen dienen: Eisensulfid (ii): Eigenschaften, Risiken und VerwendungKann von der Haut absorbiert werden. Es wird auch schnell durch Inhalation absorbiert. Die Exposition des Menschen gegenüber N, N-Dimethylanylin kann den Sauerstoffgehalt des Blutes verringern, was zu einer bläulichen Hautfarbe führt.
Die akute Inhalation dieser Verbindung kann zu negativen Auswirkungen des Zentralnervensystems und des Kreislaufsystems mit Kopfschmerzen, Zyanose und Schwindel führen.
Synthese
Es kann auf verschiedene Arten auftreten:
- Von Anilin und Methanol unter Druck in Gegenwart von Säurekatalysatoren wie H2SW4. Sulfat wird erhalten, was durch Zugabe von Natriumhydroxid zur Basis wird.
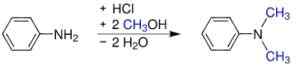 S-Synthese, N-Dimethylanylin. Werderkli - eigene Arbeit. Öffentlich zugängliche. Quelle: Wikipedia Commons.
S-Synthese, N-Dimethylanylin. Werderkli - eigene Arbeit. Öffentlich zugängliche. Quelle: Wikipedia Commons. - Ein Anilindampf und Dimethylether auf aktiviertem Aluminiumoxid übertragen.
- Erhitzen einer Mischung aus Anilin, Aniliniumchlorid und Methanol unter Druck und dann destillieren.
Anwendungen
In der Malvorlagenindustrie
Für die Eigenschaft der Reaktion mit dem Bencenodiazoniumchlorid, das Azokompiestos bildet.
Es ist Rohstoff in der Synthese der Farbstoffe der Methylviolettfamilie.
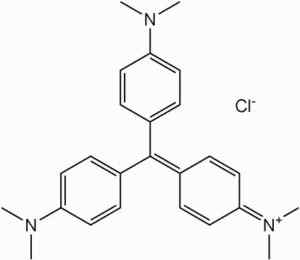 Methylviolettfarbe. Kein maschinenlesbarer Autor zur Verfügung gestellt. Shaddack übernommen (basierend auf Urheberrechtsansprüchen). [Public Domain]. Quelle: Wikipedia Commons
Methylviolettfarbe. Kein maschinenlesbarer Autor zur Verfügung gestellt. Shaddack übernommen (basierend auf Urheberrechtsansprüchen). [Public Domain]. Quelle: Wikipedia Commons In der Herstellung von fototoäenbaren Gemischen
Das N, N-Dimethylanylin ist Teil eines phototoäenbaren Gemisches, das die Heilungsreaktion infolge einer hohen Empfindlichkeit gegenüber sichtbarem Licht oder einem engen Infrarot erfährt, sodass es zum Aufnehmen von Bildern oder Photorestonierungsmaterialien verwendet werden kann.
N, N-Dimethylanylin ist eine der Komponenten der Mischung, die das Bewusstsein für Wellenlängen verursachen, so dass die Zusammensetzung mit niedriger Energiewellenleuchte geheilt wird.
Es kann Ihnen dienen: BenzolderivateEs wird geschätzt, dass die Funktion des N-N-Dimethylanylins wahrscheinlich die Unterdrückung der Terminierungsreaktion der radikalen Polymerisation durch Sauerstoff unterdrücken soll.
In der Fiberglas -Herstellung
N, N-Dimethylanylin wird in bestimmten Glasfaserharzen als katalytischer Enge verwendet.
In der Antibiotika -Synthese
N, N-Dimethylanylin beteiligt sich an der Synthese von Cephalosporinen auf Basis von Penicillins.
Penicillinsulfoxide werden in Gegenwart von Basiskatalysatoren wie N, N-Dimethylanylin in Cefeme umgewandelt.
Diese Cephalosporine weisen eine antibakterielle Aktivität gegen grampositive und gramnegative Organismen sowie gegen Penicillin-resistente Staphylokokken auf.
 Antibiotika. Alina Kuptsova. Quelle: Pixabay.
Antibiotika. Alina Kuptsova. Quelle: Pixabay. Es ist jedoch zu beachten.
Auf chemische Reaktionen
N, n-Dimethylanylin wird bei der Aktivierung von Olefin-Polymerisationskatalysatoren verwendet.
Es wird zusammen mit Pentafluorphenol (C) verwendet6F5OH) mit der die ionische Verbindung bildet [Hnphme2]+[H (oc6F5)2]-. Diese ionische Verbindung hat ein oder zwei aktive Protonen, die den Katalysator basierend auf einem Übergangsmetall aktivieren.
Zusätzlich wurde N-Dimethylanylin bei der Herstellung von Harzen als Polymerisationsbeschleuniger oder Promotor für Polyesterharze verwendet. Seine Aktion erzeugt eine schnelle Heilung des Harzes.
In mehreren Anwendungen
Es wird in der Synthese anderer chemischer Verbindungen verwendet, zum Beispiel Vanillin und als Vermittler für Arzneimittel.
Es wird auch als Lösungsmittel, als Alkylierungsmittel, als Stabilisator und zur Herstellung von Gemälden und Beschichtungen verwendet.
Verweise
- S. Nationalbibliothek für Medizin. (2019). N, N-Dimethylanilin. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Morrison, r.T. und Boyd, r.N. (2002). Organische Chemie. 6. Ausgabe. Prentice-Hall.
- (2000). N, N-Dimethylanilin. Zusammenfassung. Aus der EPA abgerufen.Regierung
- Zanaboni, p. (1966). Ungesättigte Polyester -Harz -Zusammensetzung HAVH -Stabilität und schnelle Heilung bei niedrigen Temperaturen unter Verwendung einer Mischung aus Dimethylanil, Trenhanolamin und Diphenylamin. ODER.S. Patent Nr. 3,236.915. 22. Februar 1966.
- Nudelman, a. und McCaully, r.J. (1977). Verfahren zur Umlagerung von Penicillins zu Cephalosporinen und mittlerer Kompounen davon. ODER.S. Patent Nr. 4,010.156. 1. März 1977.
- Kouji Inaishi (2001). Fotothaarige Komposition. ODER.S. Patent Nr. 6,171.759 B1. 9. Januar 2001.
- Luo, l. et al. (2012). Ionische Bransted -Säure. ODER.S. Patent Nr. 8.088.952 B2. 3. Januar 2012.
- « Rodio -Geschichte, Eigenschaften, Struktur, Verwendung, Risiken
- Akute Klänge Eigenschaften und Beispiele »

