Carbon Disulfid (CS2) Struktur, Eigenschaften, Verwendungen, Risiken
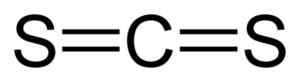
- 1162
- 324
- Lewis Holzner
Er Kohlenstoffdisulfid Es ist eine Verbindung, die durch die Vereinigung eines Kohlenstoffatoms (C) und zwei Schwefelatome (en) gebildet wird. Seine chemische Formel ist CS2. Es ist eine farblose oder leicht gelbe Flüssigkeit mit unangenehmem Geruch aufgrund der von es enthaltenden Verunreinigungen (Schwefelverbindungen). Wenn reiner Geruch weich und süß ist, ähnlich wie Chloroform oder Äther.
Es stammt natürlich aus der Wirkung des Sonnenlichts auf organische Moleküle, die in Meerwasser gefunden werden. Darüber hinaus tritt es in Sumpfgewässern auf und wird auch zusammen mit anderen Gasen aus Vulkanen ausgeschlossen.
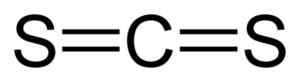 CS Carbon Disulfid2. Autor: Benjah-BMM27. Quelle: Wikimedia Commons.
CS Carbon Disulfid2. Autor: Benjah-BMM27. Quelle: Wikimedia Commons. Carbon Disulfid ist eine flüchtige Flüssigkeit und auch sehr entflammbar, sodass es von Flammen und Funken oder Geräten ferngehalten werden muss, die sie produzieren können, einschließlich elektrischer Glühbirnen.
Es hat die Fähigkeit, eine große Anzahl von Verbindungen, Materialien und Elementen wie Phosphor, Schwefel, Selen, Harze, Lack usw. aufzulösen, usw. Daher findet es Nutzen als Lösungsmittel.
Es ist auch Vermittler in verschiedenen industriellen chemischen Reaktionen wie Rayon -Produktion oder künstliche Seide.
Es muss mit Vorsicht und Schutz implementiert werden, weil es sehr giftig und gefährlich ist.
[TOC]
Struktur
Kohlenstoffdisulfid hat ein Kohlenstoffatom und zwei Schwefelatome an den Seiten davon.
Die Verbindungen zwischen dem Kohlenstoffatom und den Schwefelatomen sind kovalent und doppelt, daher sind sie sehr stark. Das CS -Molekül2 Es hat eine lineare und symmetrische Struktur.
 Lineare Struktur von Carbon Disulfid Cs2. Schwarz = Kohlenstoff, Gelb = Schwefel. Autor: Benjah-BMM27. Quelle: Wikimedia Commons.
Lineare Struktur von Carbon Disulfid Cs2. Schwarz = Kohlenstoff, Gelb = Schwefel. Autor: Benjah-BMM27. Quelle: Wikimedia Commons. Nomenklatur
- Kohlenstoffdisulfid
- Kohlenstoff Bisulfid
- Ditiocarbonicäugigenanhydrid
Eigenschaften
Körperlicher Status
Farblos bis gelblich.
Molekulargewicht
76,15 g/mol
Fusions- oder Verfestigungspunkt
-110,8 ° C
Siedepunkt
46,0 ºC
Flammpunkt
-30 ºC (Methode für geschlossene Tassen).
Selbstdirektionstemperatur
90 ° C
Dichte
Flüssigkeit = 1,26 g/cm3 bei 20 ºC.
Dampf = 2,67 mal die Luft.
Die Dämpfe sind mehr als doppelt schwer als Luft und Flüssigkeit ist schwerer als Wasser.
Dampfdruck
279 mmHg bei 25 ° C.
Kann Ihnen dienen: Kaliumhypochlorit (KCLO)Dies ist ein hoher Dampfdruck.
Löslichkeit
Sehr wenig wasserlöslich: 2,16 g/l a 25 ° C. Löslich in Chloroform. Mischbar mit Ethanol, Methanol, Ether, Benzol, Chloroform und Kohlenstofftetrachlorid.
Chemische Eigenschaften
Die CS2 Es verdunstet leicht bei Raumtemperatur, da sein Siedepunkt sehr niedrig ist und sein Dampfdruck sehr hoch ist.
Kohlenstoffdisulfid ist extrem brennbar. Seine Dämpfe sind sehr leicht entzündet, selbst mit der Hitze einer elektrischen Glühbirne. Dies bedeutet, dass es sehr schnell mit Sauerstoff reagiert:
CS2 + 3 o2 → co2 + 2 Also2
Die Tatsache, dass Sie bei Raumtemperatur einen hohen Dampfdruck haben, macht es gefährlich, nahe an einer Flamme zu sein.
Wenn er auf Zersetzung erhitzt wird. Über 90 ° C wird es spontan eingeschaltet.
Es bricht zusammen, wenn es lange gespeichert ist. Kupfer und seine Legierungen angreifen. Es reagiert auch mit einigen Kunststoffen, Gummi und Beschichtungen.
Reagiert unter bestimmten Bedingungen mit Wasser und bildet OCS -Carbonylsulfid, Kohledioxid Co2 und Wasserstoffdisulfid H2S:
CS2 + H2O → OCS + H2S
CS2 + 2 h2O → co2 + 2 h2S
Mit Alkoholern (ROH) in den alkalischen Medien bilden Xantates (RO-CS-NNA):
CS2 + ROH + NaOH → H2Oder + ro -c (= s) -sna
Erhalten
Carbon Disulfid wird kommerziell durch Schwefelreaktion mit Kohle hergestellt. Der Prozess wird bei Temperaturen von 750-900 ° C durchgeführt.
C + 2 S → CS2
Anstelle von Kohle können Sie auch Methan oder Erdgas verwenden, und sogar Ethan, Propan und Propylen wurden verwendet. In diesem Fall tritt die Reaktion bei 400-700 ° C mit hoher Leistung auf.
Es kann auch hergestellt werden, indem Erdgas mit Wasserstoffsulfid H reagiert wird2S eine sehr hohe Temperatur.
Präsenz in der Natur
Die CS2 Es ist ein Naturprodukt, das in der Atmosphäre in sehr kleinen Mengen vorhanden ist (Spuren). Es kommt photochemisch in Oberflächengewässern vor.
Die Wirkung von Sonnenlicht auf bestimmte im Meerwasser vorhandene Verbindungen wie Cystein (eine Aminosäure) führt zu einer Kohlenstoffdisulfidbildung.
 Kohlenstoffdisulfid kann durch die Wirkung von Sonnenstrahlen auf einige in Meerwasser vorhandene organische Verbindungen gebildet werden. Autor: Pexels. Quelle: Pixabay.
Kohlenstoffdisulfid kann durch die Wirkung von Sonnenstrahlen auf einige in Meerwasser vorhandene organische Verbindungen gebildet werden. Autor: Pexels. Quelle: Pixabay. Es wird auch bei vulkanischen Ausbrüchen natürlich freigesetzt und in kleinen Mengen über Sümpfen vorkommt.
Kann Ihnen dienen: BenzaldehydNormalerweise werden wir sehr kleine Ausmaße ausgesetzt und sind in einigen Lebensmitteln vorhanden. Es ist auch im Rauch der Zigaretten zu finden.
In der Umgebung zersetzt es sich durch Sonnenlicht. Auf dem Boden bewegt es sich durch ihn. Einige Bodenmikroorganismen brechen zusammen.
Anwendungen
In der chemischen Industrie
Kohlenstoffdisulfid ist eine wichtige chemische Verbindung, die dazu dient, andere Chemikalien herzustellen. Kann als chemischer Vermittler wirken.
Es wird auch als Prozesslösungsmittel verwendet.
Ermöglicht die Herstellung von pharmazeutischen Produkten und Herbiziden unter anderem.
In der Produktion von Rayón und Celofán
Mit CS2 Xantatos werden hergestellt, die Verbindungen sind, die bei der Herstellung von Rayón und Celofán verwendet werden.
Um künstliche Seide oder Rayon zu erhalten, basiert es auf Cellulose, die mit Alkali und Kohlenstoffdisulfid CS behandelt wird2 und verwandelt sich in Cellulose -Xantat, löslich in Alkali. Diese Lösung ist viskoös und wird daher als "Viscosa" bezeichnet.
Der Viskose wird unter Druck durch sehr kleine Löcher in einem Säurebad hergestellt. Hier wird das Cellulose -Xantat erneut in Cellulose umgewandelt, das unlöslich ist und lange und helle Fäden gebildet werden.
Themen oder Filamente können gedreht werden, um ein Material bekannt als Rayón zu geben.
(1) Cellulose + NaOH → Alkali-Cellosa
ROH + NaOH → Rona
(2) Alkali-Celulose + Kohlenstoffdisulfid → Cellulose Xantat
Rona + s = c = s → ro -c (= s) -sna
(3) Xantat von Cellulose + Säure → Cellulose (Filamente)
RO -C (= s) -sna + Säure → ROH
 Kleidung mit Rayon, Glasfas. Tobias "take" maier [cc by-sa (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
Kleidung mit Rayon, Glasfas. Tobias "take" maier [cc by-sa (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. Wenn die Cellulose durch das Durchsetzen der Xantato durch einen schmalen Schlitz ausgefällt wird, wird die Cellulose in Form dünner Blätter regeneriert, aus denen das Cellophan besteht. Dies wird mit Glycerin weicher und als Objektschutzfilm verwendet.
 Das Cellophan wird mit Hilfe von Kohlenstoffdisulfid hergestellt. Autor: Hans Braxmeier. Quelle: Pixabay.
Das Cellophan wird mit Hilfe von Kohlenstoffdisulfid hergestellt. Autor: Hans Braxmeier. Quelle: Pixabay. In der Produktion von Kohlenstofftetrachlorid
Kohlenstoffdisulfid reagiert mit dem Chlor -CL2 CCl mit Kohlenstofftetrachlorid geben4, Das ist ein wichtiges Lösungsmittel, das kein Kraftstoff ist.
Kann Ihnen dienen: Chlobenzol (C6H5cl)CS2 + 3 Cl2 → CCl4 + S2Cl2
In mehreren Anwendungen
Kohlenstoffdisulfid beteiligt sich an der kalten Vulkanisierung von Gummi.
Die mit CS vorbereiteten Xantatos2 Sie werden in der Mineralflotation verwendet.
Alte Verwendungen
Die CS2 Es ist ein Gift für lebende Organismen. Früher wurde es verwendet, um Schädlinge wie Ratten, Marme und Ameisen zu zerstören und die Flüssigkeit in jedem geschlossenen Raum zu gießen, in dem diese Tiere lebten (Höhlen und Hortigueros)).
Als die dichten giftigen Dämpfe für diesen Zweck verwendet wurden, beendeten sie jeden lebenden Organismus, der sich im engen Raum befand.
Es wurde auch als Antihelmintikum für Tiere verwendet und Larven von Moscardons aus dem Magen von Pferden beseitigt.
In der Landwirtschaft wurde es als Insektizid und Nematik verwendet, um den Boden zu rösten, zu Begasung von Kindergärten, Scheunen, Silos und Getreidefabriken. Eisenbahnautos, Schiffe und Lastkähne wurden ebenfalls vergrößert.
 Landwirt im Jahr 1904 den Boden mit Kohlenstoffdisulfid zur Bekämpfung einer Pest von Traubenpflanzen. Ölgemälle von Hans Pahringer, 1904 [GFDL 1.2 (http: // www.Gnu.Org/lizenzen/alte Lizenzen/FDL-1.2.html)]. Quelle: Wikimedia Commons.
Landwirt im Jahr 1904 den Boden mit Kohlenstoffdisulfid zur Bekämpfung einer Pest von Traubenpflanzen. Ölgemälle von Hans Pahringer, 1904 [GFDL 1.2 (http: // www.Gnu.Org/lizenzen/alte Lizenzen/FDL-1.2.html)]. Quelle: Wikimedia Commons. Alle diese Verwendungen wurden aufgrund der hohen Entflammbarkeit und Toxizität des CS verboten2.
Risiken
Die CS2 Es ist sehr entflammbar. Viele Ihrer Reaktionen können Feuer oder Explosion verursachen. Die Gemische ihrer Dämpfe mit Luft sind explosiv. Beim Entzündungen irritierende oder giftige Gase erzeugt.
Die Kohlenstoffdisulfid für die Abflüsse sollte nicht gegossen werden, da in den Röhrchen eine Mischung aus CS vorhanden ist2 und Luft, die eine Explosion verursachen kann, wenn sie zufällig beleuchtet wird.
Seine Dämpfe feuern spontan mit Funken oder heißen Oberflächen in Kontakt.
Kohlenstoffdisulfid reizt sich starke Augen, Haut und Schleimhäute.
Wenn das Zentralnervensystem inhaliert oder ernsthaft aufgenommen wird, das Herz -Kreislauf -System, die Augen, die Nieren und die Leber. Es kann auch durch die Haut absorbiert werden, was Schäden verursacht.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2020). Disulfidkohlenstoff. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Mopper, k. Und Kieber, D.J. (2002). Photochemie und das Radfahren von Kohlenstoff, Schwefel, Stickstoff und Pospherus. In der biogeochemität der marine gelösten organischen Substanz. Von Scientedirect erholt.com.
- Meyer, b. (1977). Industrielle Verwendungszwecke von Schwefel und seinen Komponden. Disulfidkohlenstoff. In Schwefel, Energie und Neid. Von Scientedirect erholt.com.
- Pohanish, r.P. (2012). C. Disulfidkohlenstoff. In Sittigs Handbuch mit giftigen und gefährlichen Chemikalien und Karzinogenen (sechste Ausgabe). Von Scientedirect erholt.com.
- Morrison, r.T. und Boyd, r.N. (2002). Organische Chemie. 6. Ausgabe. Prentice-Hall.
- Windholz, m. et al. (Herausgeber) (1983). Der Merck Index. Eine Enyclopedia aus Chemikalien, Medikamenten und biologischen. Zehnte Ausgabe. Merck & co., Inc.
- « Die 95 besten Sätze katholischer Heiliger
- +105 Katholische Sätze über Glauben, Reflexion, Gebet und Hoffnung »

