Schwefeldioxid (SO2) Struktur, Eigenschaften, Verwendungen, Risiken

- 3264
- 862
- Luca Holdt
Er Schwefeldioxid Es handelt2. Es ist ein farbloses Gas mit irritierenden und erstickenden Geruch. Darüber hinaus ist es wasserlösliche bildende Säurelösungen. Vulkane vertreiben ihn während der Eruptionen in die Atmosphäre.
Es ist Teil des biologischen und geochemischen Schwefelzyklus, wird jedoch in großen Mengen durch bestimmte menschliche Aktivitäten wie die Verfeinerung von Öl und brennenden fossilen Brennstoffen (Kohle oder Diesel) erzeugt (zum Beispiel).
 Schwefeldioxid so2 wird von Vulkanen während Eruptionen ausgestellt. Brocken Inaglory [CC BY-S (https: // creevecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
Schwefeldioxid so2 wird von Vulkanen während Eruptionen ausgestellt. Brocken Inaglory [CC BY-S (https: // creevecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. Das so2 Es ist ein Reduktionsmittel, mit dem Papiermulpe nach Geldwäsche mit anderen Verbindungen weiß bleiben kann. Es dient auch dazu, Chlorreste im Wasser zu beseitigen, das mit diesem Chemiker behandelt wurde.
Es wird verwendet, um einige Arten von Lebensmitteln zu behalten, um Behälter zu desinfizieren, bei denen die Fermentation von Traubensaft auftritt, um Wein oder Gerste zu produzieren, um Bier zu machen.
Es wird auch als Fungizid in der Landwirtschaft verwendet, um Schwefelsäure, als Lösungsmittel und als Vermittler bei chemischen Reaktionen zu erhalten.
Das so2 In der Atmosphäre vorhanden ist für viele Pflanzen schädlich, im Wasser beeinflusst der Fisch und ist auch einer derjenigen, die für den "sauren Regen" verantwortlich sind, der die vom Menschen geschaffenen Materialien korrodiert.
[TOC]
Struktur
Das Schwefeldioxidmolekül ist symmetrisch und bildet einen Winkel. Der Winkel ist, weil der so2 Es hat ein paar einsame Elektronen, dh Elektronen, die eine Verbindung zu jedem Atom bilden, aber frei sind.
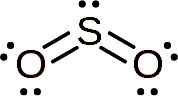 Lewis -Struktur des Schwefeldioxids, bei dem seine Winkelform und das Paar freier Elektronen beobachtet werden. Whittlemario [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Lewis -Struktur des Schwefeldioxids, bei dem seine Winkelform und das Paar freier Elektronen beobachtet werden. Whittlemario [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. Nomenklatur
- Schwefeldioxid
- Schwefelanhydrid
- Schwefeloxid.
Eigenschaften
Körperlicher Status
Farbloses Gas.
Molekulargewicht
64,07 g/mol
Schmelzpunkt
-75,5 ºC
Siedepunkt
-10,05 ºC
Dichte
Gas: 2.26 bis 0 ° C (relativ zur Luft, dh Luftdichte = 1). Dies bedeutet, dass es schwerer ist als die Luft.
Flüssigkeit: 1,4 a -10 ° C (relativ zum Wasser, dh Wasserdichte = 1).
Löslichkeit
Wasserlöslich: 17,7% bei 0 ° C; 11,9% bei 15 ° C; 8,5% bei 25 ° C; 6,4% bei 35 ° C.
Löslich in Ethanol, Dietyl Ether, Aceton und Chloroform. Es ist in nicht -polaren Lösungsmitteln weniger löslich.
pH
Die wässrigen SOS -Lösungen2 Sie sind sauer.
Chemische Eigenschaften
Das so2 Es ist ein starkes reduzierendes und oxidierendes Mittel. In Gegenwart von Luft und einem Katalysator oxidiert es so3.
SW2 + ENTWEDER2 → so3
Die Paare von Einzelelektronen lassen es sich manchmal als Basis von Lewis verhalten, mit anderen Worten, es kann mit Verbindungen reagieren, bei denen ein Atom fehlt, das Elektronen fehlt.
Es kann Ihnen dienen: Eisenanmeldung: Eigenschaften, wie sie hergestellt werden, Toxizität, verwendetWenn ja2 Es ist in Form von Gas und Trocknen greift nicht Eisen, Stahl, Kupfer-Nickel-Legierungen oder Nickelchrom-Hydrro an. Wenn es sich jedoch in einem flüssigen oder feuchten Zustand befindet, erzeugt es Korrosion für diese Metalle.
Das so2 Flüssigkeit mit 0,2% Wasser oder mehr erzeugt starke Eisen-, Messing- und Kupferkorrosion. Es ist ätzend für Aluminium.
Wenn es flüssig ist, können Sie auch einige Kunststoffe, Gummi und Beschichtungen angreifen.
Wässrige sos von so2
Das so2 Es ist sehr löslich im Wasser. Es wurde lange in Betracht gezogen, dass in Wasserschwefelsäure h h2SW3, Aber die Existenz dieser Säure wurde nicht nachgewiesen.
In so Lösungen2 In Wasser treten die folgenden Guthaben auf:
SW2 + H2Oder ⇔ so2.H2ENTWEDER
SW2.H2Oder ⇔ hso3- + H3ENTWEDER+
HSO3- + H2Oder ⇔ so32- + H3ENTWEDER+
Wo hso3- Es ist das Bisulfition und das so32- Es ist das Sulfition. Das Sulfit -Ion so32- Es tritt hauptsächlich auf, wenn ein Alkali zur SO -Lösung hinzugefügt wird2.
Die wässrigen SOS -Lösungen2 Sie haben reduzierende Eigenschaften, insbesondere wenn sie alkalisch sind.
Andere Eigenschaften
- Es ist extrem stabil im Vergleich zu Hitze, sogar bis zu 2000 ° C.
- Es ist nicht brennbar.
Erhalten
Das so2 Es wird durch Schwefelverbrennung in der Luft erhalten, obwohl auch kleine Mengen von SO -Form gebildet werden3.
S + o2 → so2
Es kann auch durch Erhitzen in der Luft verschiedener Sulfide, brennende Pyrit -Mineralien und Mineralien erzeugt werden, die Sulfide enthalten.
Im Fall des Eisenpyrit2:
4 fes2 + 11 o2 → 2 Glaube2ENTWEDER3 + 8 Also2↑
Präsenz in der Natur
Das so2 Es wird durch die Aktivität von Vulkanen (9%) in die Atmosphäre freigesetzt, stammt jedoch auch aus anderen natürlichen Aktivitäten (15%) und durch menschliche Handlungen (76%).
Explosive vulkanische Ausbrüche verursachen signifikante jährliche Schwankungen oder Variationen2 in der Atmosphäre. Es wird geschätzt, dass 25% der SO2 Von Vulkanen emittiert wird durch Regen gewaschen, bevor er die Stratosphäre erreicht.
Natürliche Quellen sind am häufigsten und sind auf den biologischen Schwefelzyklus zurückzuführen.
In städtischen und industriellen Gebieten dominieren menschliche Quellen. Die wichtigste menschliche Aktivität, die es erzeugt, ist das Verbrennen fossiler Brennstoffe wie Kohle, Benzin und Diesel. Andere menschliche Quellen sind Ölraffinerien, Chemiepflanzen und Gasproduktion.
 Menschliche Aktivitäten wie Kohleverbrennung für Elektrizität sind Verschmutzungsquelle damit2. ADREM68 [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Menschliche Aktivitäten wie Kohleverbrennung für Elektrizität sind Verschmutzungsquelle damit2. ADREM68 [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. Bei Säugetieren wird es auf endogene Weise erzeugt, dh im Körper von Tieren und Menschen aufgrund des Stoffwechsels von Aminosäuren, die Schwefel (en) enthalten, insbesondere L-Cystein.
Kann Ihnen dienen: Flüssige Elemente: Was sind und BeispieleAnwendungen
In der Produktion von Schwefelsäure
Eine der wichtigsten Anwendungen des SO2 Es ist in der Erlangung der Schwefelsäure H2SW4.
2 Also2 + 2 h2Oder + o2 → 2 h2SW4
In der verarbeiteten Lebensmittelindustrie
Schwefeldioxid wird als Lebensmittelkonservierungsmittel und Stabilisator, als Wirkstoff für die Feuchtigkeitskontrolle und als Modifikator für Geschmack und Textur bestimmter essbarer Produkte verwendet.
Es wird auch verwendet, um Geräte zu desinfizieren, die mit Lebensmitteln, Fermentationsgeräten wie Brauereien und lebenswichtigen, Lebensmittelbehältern usw. in Kontakt kommen, usw.
Es ermöglicht es, Obst und Gemüse zu sparen, seine Lebensdauer im Supermarktregal zu erhöhen, den Verlust von Farben und Geschmack zu verhindern und bei der Beibehaltung von Vitamin C (Ascorbinsäure) und Carotin (Vorläufer von Vitamin A) zu helfen.
 Getrocknete Früchte bleiben dank der SO frei von Pilzen und Bakterien2. Autor: Isabel Ródenas. Quelle: Pixabay.com
Getrocknete Früchte bleiben dank der SO frei von Pilzen und Bakterien2. Autor: Isabel Ródenas. Quelle: Pixabay.com Es dient dazu, Wein zu behalten, weil es Bakterien, Pilze und unerwünschte Hefen zerstört. Es wird auch verwendet, um die Bildung von Nitrosaminen im Bier zu sterilisieren und zu verhindern.
 Die Gerstefermentationsausrüstung, um Bier zu erhalten, sterilisiert sich damit2. Autor: Ceridebbie. Quelle: Pixabay.
Die Gerstefermentationsausrüstung, um Bier zu erhalten, sterilisiert sich damit2. Autor: Ceridebbie. Quelle: Pixabay. Es wird auch verwendet, um Maiskörner zu tränken, Rübenzucker und als antimikrobiell bei der Herstellung von mit hohem Fructose -Maissirup herzustellen.
Als Lösungsmittel und reaktiv
Es wurde weithin als nichtwässriges Lösungsmittel verwendet. Obwohl es kein ionisierendes Lösungsmittel ist, ist es als Lösungsmittel frei von Protonen für bestimmte analytische Anwendungen und chemische Reaktionen nützlich.
Es wird als Lösungsmittel und Reagenz in organischer Vermittler bei der Herstellung anderer Verbindungen wie Chlordioxid, Acetylchlorid und in Ölsulfonierung verwendet.
Als Reduktionsmittel
Es wird als Reduktionsmittel verwendet.
In mehreren Anwendungen
Das so2 Es wird auch verwendet:
- In Landwirtschaft wie Fungizid und Traubenkonservierungsmittel nach der Ernte.
- Herstellung von Hydrosulfit.
- Holz- und Papiermulpe zu bleichsen, da es das Stabilisierungsmedellnis nach Wäsche mit Wasserstoffperoxid h ermöglicht2ENTWEDER2; Das so2 Handlungen durch Zerstörung von h2ENTWEDER2 remnant und so die Helligkeit des Fruchtfleischs als h behalten2ENTWEDER2 kann eine Helligkeitsumkehr verursachen.
- Textilfasern und Korbartikel bleichten.
- Um Gewässer zu behandeln, beseitigt es das Restchlor, das nach der Chlorierung von Trinkwasser, Abwasser oder Industriegewässern bleibt.
- Bei der Verfeinerung von Mineralien und Metallen als Eisenverringerungsmittel während der Mineralverarbeitung.
- In der Verfeinerung von Öl, um Sauerstoff zu fangen und Korrosion zu verzögern, und als Extraktionslösungsmittel.
Kann Ihnen dienen: Balancing chemischer Gleichungen- Als Antioxidans.
- Als Alkalis -Neutralizer in der Glasherstellung.
- In Lithiumbatterien als Oxidationsmittel.
Auswirkungen von SO2 endogen
Bestimmte Studien haben gezeigt, dass das SO2 endogen oder durch den Organismus selbst erzeugt hat einen vorteilhaften Einfluss auf das Herz -Kreislauf -System, einschließlich der Regulierung der Funktion des Herzens und der Entspannung von Blutgefäßen.
Wenn das so im Organismus vorkommt2 Es wird zu seinen Derivaten bissulfite HSO3- und Sulfit so32-, die einen Vasorelajador -Effekt der Arterien ausüben.
Das so2 Endogener Verringerung der Hypertonie, verhindert die Entwicklung von Atherosklerose und schützt das Herz von Myokardschäden. Es übt auch eine antioxidative Wirkung aus, hemmt Entzündungen und Apoptose (programmierter Zelltod).
Aus diesen Gründen wird angenommen, dass es sich um eine mögliche neue Therapie für Herz -Kreislauf -Erkrankungen handeln kann.
 Das Herz kann vom SO profitieren2 vom Organismus erzeugt. Autor: OpenClipart-Vektoren. Quelle: Pixabay.
Das Herz kann vom SO profitieren2 vom Organismus erzeugt. Autor: OpenClipart-Vektoren. Quelle: Pixabay. Risiken
- SO2 Gasöses kann zu Verbrennungen in Augen, Haut, Hals und Schleimhäuten führen, Schäden an Bronchien und Lungen.
- Einige Studien berichten, dass es ein potenzielles Risiko einer Schädigung des genetischen Materials von Säugetier- und menschlichen Zellen hat.
- Es ist ätzend. Es ist nicht brennbar.
Ökotoxizität
Schwefeldioxid ist das häufigste Schadstoffgas in der Atmosphäre, insbesondere in städtischen und industriellen Gebieten.
Seine Anwesenheit in der Atmosphäre trägt zum sogenannten "sauren Regen" bei.
 Denkmal durch sauren Regen beschädigt. Nino Barbieri [CC BY-S (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikimedia Commons.
Denkmal durch sauren Regen beschädigt. Nino Barbieri [CC BY-S (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikimedia Commons. Das so2 Es ist giftig für Fisch. Grüne Pflanzen reagieren äußerst empfindlich für dies2 atmosphärisch. Alfalfa, Baumwolle, Gerste und Weizen werden mit geringen Umweltgrads beschädigt, während Kartoffeln, Zwiebeln und Mais viel resistenter sind.
Auswirkungen der Einnahme mit Nahrung
Obwohl es für gesunde Menschen harmlos ist, wenn es in den von autorisierten Gesundheitsbehörden empfohlenen Konzentrationen verwendet wird, ist das so2 kann Asthma zu sensiblen Menschen veranlassen, die es mit Nahrung einnehmen.
 Sensible Menschen können unter Asthma leiden, indem sie Lebensmittel mit geringen Mengen von SO einnehmen2. Suraj in Malayalam Wikipedia [Public Domain]. Quelle: Wikimedia Commons.
Sensible Menschen können unter Asthma leiden, indem sie Lebensmittel mit geringen Mengen von SO einnehmen2. Suraj in Malayalam Wikipedia [Public Domain]. Quelle: Wikimedia Commons. Die Lebensmittel, die normalerweise enthalten, sind getrocknete Früchte, künstliche Erfrischungsgetränke und alkoholische Getränke.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Dioxidschwefel. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Huang und. et al. (2016). Endogenes Schwefeldioxid: Ein neuer Mellow der Gaotransmitter -Familie im kardiovaskulären System. Oxid -Med -Zell -Longev. 2016; 2016: 8961951. NCBI erholte sich.NLM.NIH.Regierung.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Windholz, m. et al. (Herausgeber) (1983). Der Merck Index. Eine Enyclopedia aus Chemikalien, Medikamenten und biologischen. Zehnte Ausgabe. Merck & co., Inc.
- Brot, x. (2011). Oxids Schwefel: Quellen, Expositionen und gesundheitliche Auswirkungen. Gesundheitliche Auswirkungen von Schwefeloxiden. In Enzyklopädie der Umweltgesundheit. Von Scientedirect erholt.com.
- Tricker, R. und Tricker, s. (1999). Schadstoffe und Verunreinigungen. Schwefeldioxid. In Umweltanforderungen für elektromechanische und elektronische Geräte. Von Scientedirect erholt.com.
- BLEAM, W. (2017). Säure-Base-Chemie. Oxids Schwefel. In Boden- und Umweltchemie (zweite Ausgabe). Von Scientedirect erholt.com.
- Freedman, b.J. (1980). Schwefeldioxid in Lebensmitteln und Getränken: Es wird ein Konservierungsmittel und seine Auswirkung auf Asthma verwendet. Br J dis Brust. 1980; 14 (2): 128-34. NCBI erholte sich.NLM.NIH.Regierung.
- Craig, k. (2018). Eine Überprüfung der Chemie, des Pestizidgebrauchs und des Umweltschicksals von Schwefeldioxid, wie in Kalifornien verwendet. In Überprüfungen der Umweltverschmutzung und Toxikologie. Band 246. Link wiederhergestellt.Springer.com.
- « Siliziumnitruro (Si3N4) -Struktur, Eigenschaften, erhalten, verwendet, verwendet
- Aluminiumpolyloridstruktur, Eigenschaften, erhalten, verwendet, verwendet »

