Chlordioxid (CLO2) -Struktur, Verwendungen, Erhalten, Risiken, Eigenschaften

- 4091
- 1136
- Joe Hartwig
Er Chlordioxid Es ist eine anorganische Verbindung, die vom Chlorelement (CL) und Sauerstoff (O) gebildet wird. Seine chemische Formel ist CLO2. Es ist ein grünliches bis rötliches gelbes Gas. Es ist natürlich nicht in der Umwelt zu finden.
Es ist extrem reaktiv, daher ist es üblich, dass es an dem Ort vorbereitet wird, an dem es verwendet wird. Einer seiner wichtigsten Verwendungen ist das Mikrobizid, antiseptisch und deodorierend, da es Bakterien, Viren und Pilze sehr leicht und in sehr niedrigen Konzentrationen beseitigt.
 Einige in Supermärkten verkaufte Lebensmittel wurden möglicherweise mit Clo Chlordioxid desinfiziert2. Autor: ElasticComputeFarm. Quelle: Pixabay.
Einige in Supermärkten verkaufte Lebensmittel wurden möglicherweise mit Clo Chlordioxid desinfiziert2. Autor: ElasticComputeFarm. Quelle: Pixabay. Es ermöglicht es, Lebensmittel wie Gemüse, Obst, Fleisch, Vögel und Meeresfrüchte zu desinfizieren. Es dient dazu, Oberflächen, Böden, Badezimmer, Lüftungssysteme, Schwimmbäder, Laborgeräte, Zahnarztausrüstung usw.
Daher wird es in der Lebensmittelverarbeitung, in Krankenhäusern und Kliniken, in Branchen und Geschäften verwendet. Es wird verwendet, um das zum Trinken verwendete Wasser und auch das kommunale Abwasser zu reinigen.
Als Oxidationsmittel ist es sehr effektiv, daher wird es verwendet, um Papierzellstoff, Öle, Mehl, Leder und Textilfasern zu bleichen.
Wenn es in Form von Gas ist, ist es sehr gefährlich, da es sehr explosiv ist und hauptsächlich in wässrigen Lösungen verwendet wird. Es ist giftig, wenn es einatmet.
[TOC]
Struktur
Chlordioxid wird durch die Vereinigung eines Chloratoms (CL) mit zwei Sauerstoffatomen (O) gebildet. Chlorverbindungen mit jedem Sauerstoff sind kovalent und doppelt doppelt. Das Chlor in dieser Verbindung hat eine Valenz von +4.
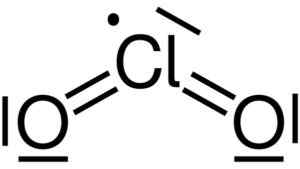 Lewis -Struktur von Chlordioxid2. Yikrazuul [Public Domain]. Quelle: Wikimedia Commons.
Lewis -Struktur von Chlordioxid2. Yikrazuul [Public Domain]. Quelle: Wikimedia Commons. Es hat eine symmetrische und winkelförmige Struktur, da es freie Elektronen hat. Das heißt, sie bilden keine Verbindung mit einem anderen Atom.
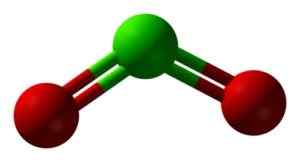 CLO -Struktur2 In drei Dimensionen. Grün = Chlor; Rot = Sauerstoff. Ben Mills und Jynto [Public Domain]. Quelle: Wikimedia Commons.
CLO -Struktur2 In drei Dimensionen. Grün = Chlor; Rot = Sauerstoff. Ben Mills und Jynto [Public Domain]. Quelle: Wikimedia Commons. Nomenklatur
- Chlordioxid
- Chloroxid (iv)
Eigenschaften
Körperlicher Status
Grünlich gelb bis rötlich gelbes Gas.
Molekulargewicht
67,45 g/mol.
Schmelzpunkt
-59 ºC.
Siedepunkt
11 ºC.
Dichte
Flüssigkeit bei 0 ° C = 1.642 g/cm3
Gas = 2,33 (Luft -Relativdichte, Luft = 1).
Es kann Ihnen dienen: Isoamylalkohol: Struktur, Eigenschaften, Verwendung und RisikenLöslichkeit
Wasserlöslich: 2000 cm3 des Clo2 Gas bei 100 cm3 kaltes Wasser oder 0,8 g/100 ml Wasser bei 20 ° C. Löslich in alkalischer Lösung und in Schwefelsäurelösung h2SW4.
Chemische Eigenschaften
Der Clo2 Es ist extrem reaktiv und kann heftig ausnutzen. Es ist ein sehr effektiver Oxidationsmittel.
Der Clo2 Es bricht heftig, wenn es mit organischen Materialien in Kontakt kommt. Wenn Sie in einer Konzentration von mehr als 10% in Luft sind, kann es aufgrund von Sonnenlicht oder Wärme explodieren.
Sie können auch in Gegenwart von Quecksilber (HG) oder Kohlenmonoxid (CO) detonieren.
Unter der Wirkung von Ultraviolett (UV) oder Ozon die CLO2 Es wird Chlorhexoxid2ENTWEDER6, Sehr instabile Verbindung.
Eigenschaften Ihrer wässrigen Lösungen
Seine wässrigen Lösungen sind gelb oder rotgelb gelb. Sie sind stabil, wenn sie kalt, gut versiegelt und vor Sonnenlicht geschützt bleiben. In Gegenwart von Licht werden diese Lösungen langsam abgebaut, um HCL -Salzsäure und HCLO -Chlorsäure zu verleihen3.
 Wasserlösung von CLO2 wo beobachtet wird, dass ein gelbes Gas freigesetzt wird, das der Clo ist2. Autor: MaterialScientist. Quelle: Wikimedia Commons.
Wasserlösung von CLO2 wo beobachtet wird, dass ein gelbes Gas freigesetzt wird, das der Clo ist2. Autor: MaterialScientist. Quelle: Wikimedia Commons. In den alkalischen Lösungen der Clo2 Es ist in Ionen Chlorit Clo unterteilt2- und Klory3-. In Säurelösungen bildet Chlorsäure HCLO2 Und dann wird dies auf HCL -Salzsäure und HCLO -Chlorsäure abgebaut3.
Andere Eigenschaften
Die konzentrierten Dämpfe von CLO2 Sie sind potenziell explosiv, daher war es nicht möglich, nicht mit anderen Gasen zu komprimieren. Aus diesem Grund wird es bevorzugt, es an der Stelle vorzubereiten, an der es verwendet wird.
Wenn es in seiner hydratisierten Form sehr niedrige Temperaturen ist, die die Art und Weise, wie es manchmal übertragen wird, ist es ein Feststoff in Form eines eisähnlichen Blocks und Orange.
Es hat einen Geruch ähnlich wie Chlor. Ist durch Inhalation toxisch.
Erhalten
Kann auf verschiedene Arten erhalten werden. Zum Beispiel in einigen Fällen die CLO -Lösungen2 Sie bereiten sich darauf vor, eine Mischung aus Chlorgas (CL) zu passieren2) und Luft (oder Chlor- und Stickstoffgas2) durch eine Säule, die Natriumchloritgranulate enthält (NaClo2).
Kann Ihnen dienen: Valencia -Schicht2 Naclo2 + Cl2 → 2 NaCl + 2 clo2
Das erzeugte Produkt enthält ungefähr 90% CLO2, Unter anderen Chlorverbindungen.
Es wird auch aus Kaliumchlorat (KCLO3) und Schwefelsäure (h)2SW4) In Gegenwart von Oxalsäure als Reduzierer. In diesem Fall wird auch Kohlendioxid gebildet (CO2) Das dient dazu, den CLO zu verdünnen2.
Es kann an der Nutzungsstelle basierend auf Natriumchlorat (NACLO) vorbereitet werden3), Schwefelsäure (h)2SW4) und Methanol (wählen3OH).
In der Branche wird es durch Natriumchlorat (NACLO "erhalten3) und Schwefeldioxid (also2) In Gegenwart von Schwefelsäure.
2 Naclo3 + SW2 + H2SW4 → 2 clo2 + 2 Nahso4
Verwendet als Desinfektionsmittel
Es kann als starkes antimikrobielles Mittel verwendet werden. Es wurde festgestellt, dass es gegen mehrere Mikroorganismen hochwirksam ist, wie z Escherichia coli und das Staphylococcus aureus.
Mit letzterem eine Konzentration von nur 5 ppm Clo2 100% von ihnen zu beseitigen. Es ist bakterizid, antiseptisch und deodorierend. Es ist in einem breiten pH -Intervall wirksam.
Im Essen
Es wird als antimikrobielles Mittel im Wasser verwendet.
 Das rote Fleisch von Supermärkten wurde möglicherweise mit Chlordioxid behandelt, um sie zu desinfizieren. Autor: Karamo. Quelle: Pixabay.
Das rote Fleisch von Supermärkten wurde möglicherweise mit Chlordioxid behandelt, um sie zu desinfizieren. Autor: Karamo. Quelle: Pixabay. Chlordioxidlösungen sollten in einer Konzentration verwendet werden, die 3 ppm (Parties pro Million) CLO nicht überschreitet2 Residuum, damit es keinen Einfluss auf die Lebensmittel hat.
Nach der Behandlung mit CLO2 Alle Lebensmittel müssen vollständig mit Trinkwasser regiert werden oder sollten als verteilt, kochen oder konserviert verwendet werden.
Bei Marineprodukten die Abwasserlösung2 Es sollte in Wasser und Eis verwendet werden, die in der Spülung, dem Waschen, dem Auftauen, dem Transport oder der Lagerung verwendet werden. Rohe Meeresfrüchte müssen dann vor dem Verbrauch sehr gut mit Trinkwasser gewaschen werden.
 Kaltes Wasser und Eis, mit dem Meeresfrüchte kleine Mengen CLO enthalten2. Autor: Public Domainpartures. Quelle: Pixabay.
Kaltes Wasser und Eis, mit dem Meeresfrüchte kleine Mengen CLO enthalten2. Autor: Public Domainpartures. Quelle: Pixabay. Auf Papier und Karton, das mit Lebensmitteln in Kontakt kommt
CLO -Lösungen2 Sie werden verwendet, um Mikroorganismen zu beseitigen, die Slim (wie Algen, Bakterien und Pilze) verursachen, in dem für die Herstellung von Papier und Karton verwendeten Prozess Wasser, das mit Lebensmitteln in Kontakt kommt.
Kann Ihnen dienen: apolare MoleküleIn Trinkwasser
Es dient dazu, Wasser zu reinigen und es trinkbar zu machen (sicher zu trinken). Es wird in der Vorbehandlung mit Wasser verwendet, die dann zum Trinken oder Wasser abgefüllt werden, das als Zutat bei der Herstellung von Getränken oder Erfrischungsgetränken verwendet wird.
 Einige verarbeitete Erfrischungsgetränke können behandeltes Wasser mit CLO enthalten2. Susan Slater [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Einige verarbeitete Erfrischungsgetränke können behandeltes Wasser mit CLO enthalten2. Susan Slater [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. In der Zahnmedizin
Es wird in den Instrumenten verwendet.
In medizinischen Anwendungen
Die wässrigen Lösungen von CLO2 Sie wurden verwendet, um orale Candidiasis (Mundinfektion) zu behandeln. Candidiasis ist eine Pilzinfektion Candida albicans.
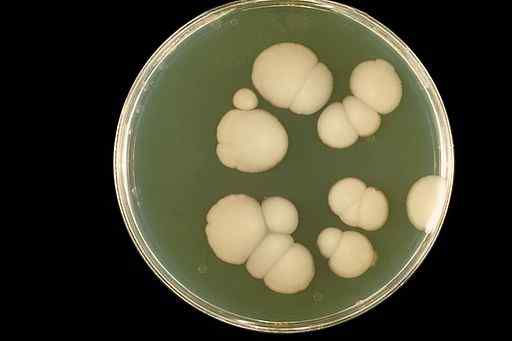 Candida albicans Pilz -Auftritt in einer Laborernte. CDC/DR. William Kaplan [Public Domain]. Quelle: Wikimedia Commons.
Candida albicans Pilz -Auftritt in einer Laborernte. CDC/DR. William Kaplan [Public Domain]. Quelle: Wikimedia Commons. Chlordioxid eliminiert den Mund aus dem Mund und verbessert das Erscheinungsbild von Mundgeweben ohne Nebenwirkungen signifikant.
Einige medizinische Forscher geben an, dass CLO -Lösungen2 Angewendet auf chirurgische Operationen können die Bildung von Akzessionen verringern oder unterdrücken, ohne die Heilung derselben zu beeinflussen, mit dem zusätzlichen Vorteil seiner antiseptischen Eigenschaften.
Andere Verwendungen
Für seine oxidierenden und mikrobiziden Eigenschaften der CLO2 wird verwendet für:
- Bleichmittel die Zellulose des Holzes bei der Herstellung von Zellstoff und Papier und sorgt für einen stabilen Glanz.
- Dekorieren Sie Fette und Öle, Leder, Weißmehl und Textilien.
- Landwirtschaftliche Anwendungen wie Desinfektion mit harten Oberflächen, Ausrüstung, Wassersystemen und Pilzhäusern.
- Bewerbungen in Branchen, Geschäften und Krankenhäusern wie Desinfektion mit harten Oberflächen (Wände, Böden, Badezimmer), Lüftungssysteme, Laborgeräte.
- Desinfektion Wohnungen und Badezimmer von Haushalten, Klimaanlagen, Schwimmwasserzirkulationssysteme.
- Die Behandlung von kommunalem und industriellem Abwasser.
- Verschmutzungsreinigung von Ölfeldern.
- Herstellung von Chloridsalzen (CL-).
Risiken
- Die konzentrierten Dämpfe von CLO2 Sie sind potenziell explosiv.
- Es ist durch Inhalation und Aufnahme giftig. Es ist irritierender Auge, Nase und Hals, kann Lungenödem und chronische Bronchitis verursachen.
- Nach Angaben der Quellen konsultierten die CLO2 verursacht keine DNA -Mutationen oder verursacht den Menschen Krebs.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Chlordioxid. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Dean, J.ZU. (Editor). (1973). Lange's Handbuch der Chemie (elfte Ausgabe). McGraw-Hill Book Company.
- Ullmanns Enzyklopädie der industriellen Chemie. (1990). FÜNFTE AUSGABE. VCH Verlagsgellschaft MBH.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Bajpai, p. (2012). Chlordioxidbleiche. Einfluss des Chlordioxidbleiches auf die Zellstoffqualität. In umweltgütigen Ansätzen für Pulp Bleaching (zweite Ausgabe). Von Scientedirect erholt.com.
- Moran, s. (2018). Wasserchemie. Chlordioxid. In einem angewandten Leitfaden für Wasser- und Abwasserbehandlungsanlagendesign. Von Scientedirect erholt.com.
- McKen, l. (2012). Einführung in die Lebensmittelradition und die medizinische Sterilisation. Gasous Chorin -Stördel. Bei der Sterilisation auf Kunststoff und Elastomere (dritte Ausgabe). Von Scientedirect erholt.com.
- « Obere paläolithische Merkmale, Kunst, soziale Organisation
- Sulfonsäurestruktur, Nomenklatur, Eigenschaften, verwendet »

