Clausius-Clapeyron-Gleichung Was ist es, Beispiele, Übungen
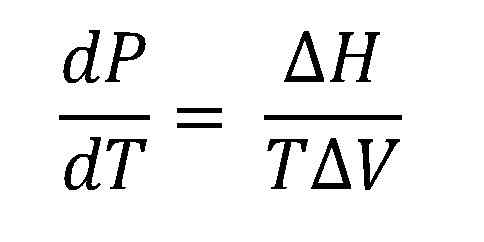
- 1201
- 2
- Joy Hort
Der Clausius-Clapeyron-Gleichung Es ist eines, das die Änderungen des Dampfdrucks und der Temperatur in einer Phase oder einer Änderung des Zustandsübergangs bezieht. Gilt für Sublimationen, Verdunstungen, Fusionen oder sogar bei Veränderungen in kristallinen Phasen. Es ist erwähnenswert, dass diese Gleichung für eine reine Substanz gilt, die sich im Gleichgewicht befindet.
Diese Gleichung leitet sich aus den thermodynamischen Gesetzen und P-T-Diagrammen für eine Substanz ab, in der die Koexistenzlinie beobachtet wird; Das, was zwei verschiedene Phasen trennt (Flüssigkeitsvor, Feststoff-Flüssigkeit usw.). Um diese Linie, den Gewinn oder den Wärmeverlust zu übertragen, ist erforderlich, z. B. die Enthalpie von Verdampfungen, ΔHVAP.
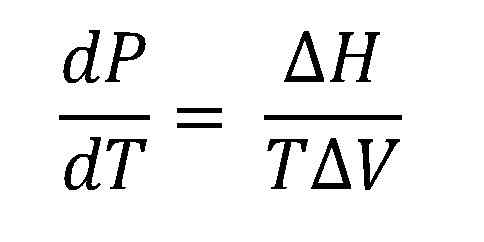 Clausius-Clapeyron-Gleichung. Quelle: Gabriel Bolívar.
Clausius-Clapeyron-Gleichung. Quelle: Gabriel Bolívar. Das höhere Bild zeigt die Clausius-Clapeyron-Gleichung, bevor sie integriert werden. Normalerweise wird es normalerweise auf Flüssigkeits-Dampfsysteme angewendet, wobei ΔH verwendet wirdVAP und Sie möchten berechnen, was der flüssige Dampfdruck bei einer bestimmten Temperatur entspricht. Es dient auch dazu, das ΔH zu berechnenVAP einer bestimmten Flüssigkeit in einem Temperaturbereich.
Die Clausisu-Clapeyron-Gleichung wird auch häufig verwendet, um Druckänderungen in flüchtigen Feststoffen zu untersuchen. Das heißt, die Sublimationenthalpie wird berücksichtigt, ΔHSub.
[TOC]
Was ist die Clausisu-Clapeyron-Gleichung für?
Berechnung des Drucks von Druck und Enthalpie der Verdampfung
Aus der Gleichung von Clausius-Clapeyron von oben werden einige mathematische Überlegungen schließlich gemacht, um schließlich eine Integration durchzuführen. Zum Beispiel wird für ein Flüssig-Dampf-System angenommen, dass ΔHVAP Es variiert nicht mit der Temperatur, und dieser ΔV entspricht ausschließlich dem Volumen des Dampfes, wobei das Volumen der Flüssigkeit (VDampf-Vflüssig = VDampf).
Unter der Annahme, dass Steam sich als ideales Gas und Integration verhält, wird die Gleichung von Clausius-Clapeyron integriert:
Kann Ihnen dienen: Volatilisation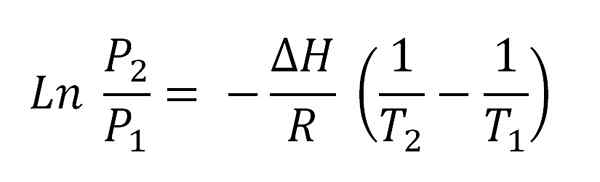 Clausius-Clapeyron-Gleichung integriert.
Clausius-Clapeyron-Gleichung integriert. Diese Gleichung entspricht der einer Linie, die grafisch ist wie:
Ln p vs 1/t
Und deren negative Steigung ist (ΔH/R). Um diese Gleichung zu erfüllen, muss ΔH im Temperaturintervall konstant sein (t2-T1), in denen Dampfdrücke im Gleichgewicht mit der Flüssigkeit gemessen werden.
Wenn angenommen wird, dass ΔH in kleinen Temperaturintervallen wenig variiert, ist es möglich, die Gleichung dieser Linie zu verwenden, um Änderungen des Dampfdrucks einer Flüssigkeit vorherzusagen. Und noch mehr können Sie den ΔH der Verdampfung bestimmen.
Je größer die Temperaturenintervalle betrachtet werden, desto größter Abweichung dieser Gleichung der experimentellen Daten und desto geringer wird sie erfüllt.
Bestimmung der Phasenänderungen
Somit wird die Gleichung von Clausius-Clapeyron zur Entwicklung einer Tangentenlinie zur Koexistenzlinie zwischen zwei physikalischen Phasen, die in jedem P-T-Diagramm für eine Substanz beobachtet wird.
Wenn eine Phasenänderung auftritt, wird sich die Neigung ändern, und ΔH ist nicht dasselbe. Wenn daher starke Abweichungen nachgewiesen werden und die Gleichung fehlschlägt, ist dies ein Vorzeichen, dass im Temperaturintervall die Substanz eine andere Phasenänderung aufweist. Das heißt, es hört auf, ein Flüssig-Dampf-System zu sein, da es an die Koexistenzlinie übergeben wird.
Beispiele verwenden
- Die Clausius-Clapeyron-Gleichung wurde in der Meteorologie verwendet, um das Verhalten der Wolken zu untersuchen, sogar diejenigen, die auf anderen Planeten oder Monden mit Atmosphären vorhanden sind.
Kann Ihnen dienen: Gluconsäure: Struktur, Eigenschaften, Synthese, verwendet- Es wurde verwendet, um die Fusionenthalpie mehrerer Metalle wie Natrium und Gallium zu bestimmen und ihre Dampfdrücke bei sehr hohen Temperaturen zu extrapolieren.
- Es wurde auch verwendet, um die Enthalpie der Verdampfung von Substanzen wie gasöses Chlor, Kohlenstofftetrachlor, Flüssigkeitswasser, Eis und Jod zu bestimmen.
- Es hat auch die Untersuchung der Phasenveränderungen in kristallinen Strukturen gedient. In diesem letzten Beispiel sieht die integrierte Gleichung von Clausius-Clapeyron bemerkenswert unterschiedlich aus, da die gleichen Überlegungen, die für das Liquid-Vapor-System aufgenommen werden, nicht für ΔV gemacht werden können. Die Volumenschwankungen von einer Phase zur anderenmal sind klein.
Gelöste Übungen
- Übung 1
Der Eisdampfdruck beträgt 4.58 Torr bei 0 ° C und 1.95 Torr a -10 ° C. Was ist Ihre Sublimationenthalpie in diesem Temperaturbereich??
Beachten Sie, dass wir zwei Drücke und zwei Temperaturen haben:
P1 = 4.58 Torr
P2 = 1.95 Torr
T1 = 0 ° C + 273 = 273 K
T2 = -10 ° C + 273 = 263 K
Wir konvertieren die Temperatureinheiten von ° C nach k, da der konstante R von Gasen K in seinen Einheiten enthält:
R = 8.314 j/k
Somit verwenden wir die integrierte Clausius-Clapeyron-Gleichung und das klare ΔHSub, das würde bleiben als:
ΔHSub = -Rln (p2/P1) / (1 / t2 - 1 /t1)
Für mehr Komfort wird nur durch die Zahlen ersetzt, aber zu wissen, dass die endgültige Einheit der Joule ist:
ΔHSub = -(8.314) ln (1.95/4.58)/(1/263 - 1/273)
= 50.97 J
Oder 51.07 J Berücksichtigen Sie nur wenige Dezimalstellen. Dieser Wert wird abhängig von den Intervallen t oszillationen auftreten2-T1 und bestimmter Dampfdruck.
- Übung 2
Der Siedepunkt von Ethanol bei einem Druck von 760 Torr (1 atm) beträgt 78.3 ° C, und seine Verdampfenthalpie beträgt 39.3 KJ. Was wird Ihr Dampfdruck bei einer Temperatur von 46 ° C sein??
Es kann Ihnen dienen: Tantalus: Struktur, Eigenschaften, Verwendungen, ErhaltenWir identifizieren die Daten:
P1 = 760 Torr
P2 = ?
T1 = 78.3 ° C + 273 = 351.3 k
T2 = 46 ° C + 273 = 319 K
ΔHVAP = 39.3 KJ oder 39300 J
Also müssen wir p klären2 der integrierten Clausius-Clapeyron-Gleichung. Auch hier werden die Einheiten aus Komfort weggelassen und die Berechnungen werden Schritt für Schritt entwickelt:
Ln (p2/P1) = -(ΔHVAP/R) (1/t2 - 1/t1)
Ln (p2/760) = -(39300/8.314) (1/319 - 1/351.3)
Ln (p2/760) = -1.36
Anwenden der exponentiellen Funktion auf beiden Seiten der Gleichung, um p löschen zu können2 wir werden haben:
E (ln p2/760) = e(-1.36)
P2/760 = 0.256
P2 = 0.256 (760)
= 195 Torr
Bei einer niedrigeren Temperatur (46 ° C) niedrigeren Dampfdruck (195 Torr). Tatsächlich haben das Ethanol einen Druck von 760 Torr auf 78.3 ° C, wir sprechen über den normalen Siedepunkt. Dies ist das Verhalten, das für alle Flüssigkeiten erwartet wird
Im Allgemeinen bestehen Clausius-Clapeyron-Übungen dieser Art aus Clearing p2, T2 oder ΔH der Verdampfung oder Sublimation. Die Berechnungen ändern sich erheblich, wenn ΔV ebenfalls berücksichtigt werden sollte, insbesondere wenn es um Festkörpersysteme oder -Balancen geht.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Wikipedia. (2020). Clausius-Clapeyron-Beziehung. Abgerufen von: in.Wikipedia.Org
- San José State University. (S.F.). Die Clausius-Clapeyron-Gleichung:
STIS -Ableitung und Anwendung in Meteorologie. Erholt von: SJSU.Edu - Bodner -Gruppe. (S.F.). Die Clausius-Clapeyron-Gleichung. Abgerufen von: Chemed.Chem.Purdue.Edu
- Chieh c. & Censulo a. (18. Mai 2020). Clausius-Clapeyron-Gleichung. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Walter J. Moore. (1962). Physikalische Chemie. (Vierte Edition). Longmans.
- « 7 Gedichte über die Umgebung bekannter Autoren
- Lernen für Entdeckungstheorie, Beispiele, Aktivitäten »

