Henderson-Haselbalch-Gleichung Erklärung, Beispiele, Übung
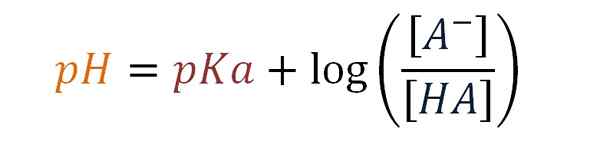
- 2137
- 99
- Joy Hort
Der Henderson-Haselbalch-Gleichung Es ist ein mathematischer Ausdruck, der die Berechnung des pH -Werts eines Stoßdämpfers oder einer Dämpfungslösung ermöglicht. Es basiert auf der PKA der Säure und der Beziehung zwischen Konjugat- oder Salz- und Säurekonzentrationen, die in der Dämpfungslösung vorhanden sind.
Die Gleichung wurde ursprünglich 1907 von Lawrence Joseph Henderson (1878-1942) entwickelt. Dieser Chemiker hat die Komponenten seiner Gleichung basierend auf Carbonsäure als Puffer- oder Pufferlösung festgelegt.
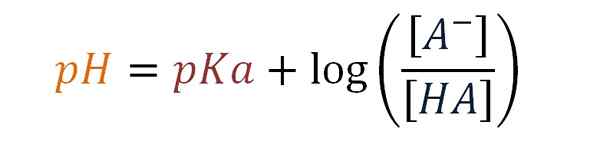 Henderson-Haselbalch-Gleichung. Quelle: Gabriel Bolívar.
Henderson-Haselbalch-Gleichung. Quelle: Gabriel Bolívar. Anschließend führt Karl Albert Hasselbalch (1874-1962) 1917 die Verwendung von Logarithmen zur Ergänzung der Henderson-Gleichung ein. Der dänische Chemiker untersuchte Blutreaktionen mit Sauerstoff und die Wirkung auf seinen pH -Wert.
Eine Pufferlösung kann pH -Veränderungen minimieren. Es wird durch eine schwache Säure und ihre stark konjugierte Base gebildet, die schnell dissoziiert wird.
[TOC]
Erläuterung
Mathematische Entwicklung
Eine schwache Säure in einer wässrigen Lösung dissoziiert nach dem folgenden Schema nach dem Massenaktionsgesetz:
Ha +h2Oder ⇌ h+ + ZU-
Ha ist schwachsäure und- Ihre konjugierte Basis.
Diese Reaktion ist reversibel und hat eine Gleichgewichtskonstante (KA):
Ka = [h+] ·[ZU-] / [Ha]
Logarithmen nehmen:
log ka = log [h+] +Log [a-] -log [ha]
Wenn jeder Term der Gleichung mit (-1) multipliziert wird, wird sie auf folgende Weise ausgedrückt:
- log ka = - log [h+] -log [a] +log [ha]
Das - log ka ist definiert als PKA und das - log [h) definiert+] wird als pH definiert. Nach dem Ersetzen der Fälligkeit wird der mathematische Ausdruck auf:
pka = ph -log [a-] +Log [ha]
Wenn Sie den pH -Wert und die Umgruppierung von Begriffen beseitigen, wird die Gleichung auf folgende Weise ausgedrückt:
Kann Ihnen dienen: Dreifach kovalenter LinkPH = PKA +log [a-] / [Ha]
Dies ist die Henderson-Haselbalch-Gleichung für einen Stoßdämpfer, der durch eine schwache Säure gebildet wird.
Gleichung für eine schwache Basis
In ähnlicher Weise kann eine schwache Basis eine Pufferlösung bilden, und die Henderson-Haselbalch-Gleichung ist wie folgt:
Poh = pkb +log [hb] / [b)-]
Die meisten Dämpfungslösungen entstehen jedoch, einschließlich der von physiologischen Bedeutung, aus der Dissoziation einer schwachen Säure. Daher ist der am häufigsten verwendete Ausdruck für die Henderson-Haselbalch-Gleichung:
PH = PKA +log [a-] / [Ha]
Wie handelt eine Pufferlösung??
Stoßdämpferwirkung
Die Henderson-Haselbalch-Gleichung zeigt an, dass diese Lösung durch eine schwache Säure und eine stark konjugierte Base gebildet wird, die als Salz ausgedrückt wird. Diese Zusammensetzung ermöglicht es der Dämpfungslösung, mit einem stabilen pH -Wert zu bleiben, obwohl starke Säuren oder Basen zugesetzt werden.
Durch Hinzufügen einer starken Säure zum Stoßdämpfer reagiert sie mit der konjugierten Basis, um Salz und Wasser zu bilden. Dies neutralisiert die Säure und ermöglicht die Variation des pH -Werts minimal.
Wenn der Stoßdämpfer nun eine starke Basis zugesetzt wird, reagiert sie mit schwacher Säure-, Wasserform und Salz, wodurch die Wirkung der zugesetzten Basis auf den pH -Wert neutralisiert wird. Daher ist die pH -Variation minimal.
Der pH -Wert einer Pufferlösung hängt von der Beziehung der Konjugat -Basenkonzentrationen und der schwachen Säure und nicht von dem absoluten Wert der Konzentrationen dieser Komponenten ab. Eine Dämpfungslösung mit Wasser kann verdünnt werden und der pH -Wert variiert praktisch nicht.
Stoßdämpferkapazität
Die Dämpfungskapazität hängt auch von der PKA von schwacher Säure sowie den Konzentrationen von schwacher Säure und konjugierter Base ab. Je näher an der Säure PKA der pH -Wert der Dämpfungslösung ist, desto größer ist die Dämpfungskapazität.
Kann Ihnen dienen: Le châtelier PrinzipJe größer die Konzentration der Komponenten der Pufferlösung, desto größer ist die Dämpfungskapazität.
Beispiele für Henderson -Gleichungen
Acetatpuffer
PH = PKA +log [CHO3Gurren-] / [Cho3Cooh]
PKA = 4,75
Kohlensäure -Amortid
PH = PKA +log [HCO3-] / [H2CO3]
PKA = 6,11
Der globale Prozess, der zur Bildung des Bicarbonat -Ions in einem lebenden Organismus führt, ist jedoch wie folgt:
CO2 + H2Oder ⇌ hco3- + H+
CO sein2 Ein Gas, seine Konzentration in Lösung wird nach seinem Teildruck ausgedrückt.
PH = PKA +log [HCO3-] / α · Pco2
α = 0,03 (mmol/l)/mmHg
PCO2 ist der Teildruck des CO2
Und dann wäre die Gleichung als:
PH = PKA +log [HCO3-] / 0,03 · Pco2
Laktat -Stoßdämpfer
PH = PKA +log [Laktation] / [Milchsäure]
PKA = 3,86
Phosphat -Stoßdämpfer
PH = PKA +log [Dibasic Phosphat] / [monobasisches Phosphat]]]
PH = PKA +log [HPO42-] / [H2Po4-]
PKA = 6,8
Oxihemoglobin
PH = PKA +log [HBO2-] / [HHBO2]
PKA = 6,62
Desoxyhämoglobin
PH = PKA +log [Hb-] / Hbh
PKA = 8,18
Gelöste Übungen
Übung 1
Der Phosphat -Stoßdämpfer ist wichtig für die Regulation des KörperpH -Werts, da sein PKA (6,8) nahe am pH -Wert im Körper liegt (7,4). Was wird der Wert der Beziehung sein [NA2HPO42-] / [Nah2Po4-] der Henderson-Haselbalch-Gleichung für einen Wert von pH = 7,35 und ein PKA = 6,8?
Nahs Dissoziationsreaktion2Po4- Ist:
Nein2Po4- (Säure) ⇌ NaHpo42- (Basis) +h+
PH = PKA +log [Na2HPO42-] / [Nah2Po4-]
Die [konjugierte / Säure] -Beziehung für die Phosphat -Dämpfungslösung löschen, haben wir:
7,35 - 6,8 = log [NA2HPO42-] / [Nah2Po4-]
0,535 = log [na2HPO42-] / [Nah2Po4-]
100,535 = 10log [na2hpo4] / [nah2po4]
Es kann Ihnen dienen: Diphenylamin3.43 = [NA2HPO42-] / [Nah2Po4-]
Übung 2
Eine Acetatpufferlösung hat eine 0,0135 M Essigsäurekonzentration und eine Natriumacetat -Konzentration von 0,0260 m. Berechnen Sie den pH -Wert der Stoßdämpferlösung und wissen, dass die PKA für den Acetat -Stoßdämpfer 4,75 beträgt.
Das Dissoziationsgleichgewicht für Essigsäure lautet:
CH3Cooh ⇌ ch3Gurren- + H+
PH = PKA +log [CHO3Gurren-] / [Cho3Cooh]
Ersetzen der Werte, die wir haben:
[CH3Gurren-] / [Cho3COOH] = 0,0260 m / 0,0135 m
[CH3Gurren-] / [Cho3Cooh] = 1.884
log 1,884 = 0,275
pH = 4,75 +0.275
pH = 5,025
Übung 3
Ein Acetat -Stoßdämpfer enthält 0,1 m Essigsäure und 0,1 M Natriumacetat. Berechnen Sie den pH -Wert der Dämpfungslösung nach Zugabe von 5 ml 0,05 m bei 10 ml Salzsäure.
Der erste Schritt besteht darin, die Endkonzentration des HCl beim Mischen mit der Pufferlösung zu berechnen:
Vi · ci = vf · vgl
CF = vi · (CI / VF)
= 5 ml · (0,05 m / 15 ml)
= 0,017 m
Salzsäure reagiert mit Natriumacetat, um Essigsäure zu bilden. Daher nimmt die Natriumacetatkonzentration um 0,017 m ab und die Essigsäurekonzentration nimmt um die gleiche Menge zu:
PH = PKA +log (0,1 m - 0,017 m) /(0,1 m +0,017 m)
PH = PKA +log 0,083 / 0,017
= 4,75 -0.149
= 4,601
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Jimenez Vargas und J. Mª Macarulla. (1984). Physiologische physikalisch -chemische. 6. Ausgabe. Inter -American Editorial.
- Wikipedia. (2020). Henderson-Hasselbalch-Gleichung. Abgerufen von: in.Wikipedia.Org
- Gurinder Khaira & Alexander Kot. (5. Juni 2019). Henderson-Hasselbalch-Näherung. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Helmestine, Anne Marie, ph.D. (29. Januar 2020). Henderson Hasselbalch -Gleichungsdefinition. Erholt von: thoughtco.com
- Die Herausgeber von Enyclopaedia Britannica. (6. Februar 2020). Lawrence Joseph Henderson. Encyclopædia Britannica. Erholt von: Britannica.com
- « Vorwortmerkmale, Funktionen, Beispiele und Teile
- Fundamentrefraktometrie, Refraktikertypen, Anwendungen »

