Elektrophilenreaktionen, Beispiele, Elektrophilie
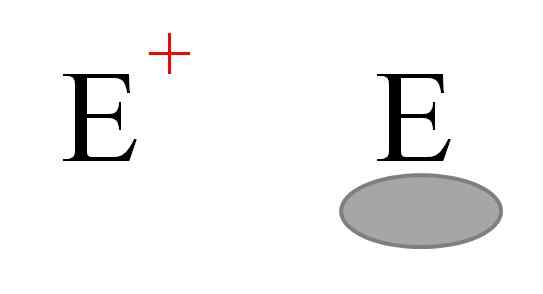
- 4103
- 812
- Timo Rabenstein
A Elektrophile Es ist alles, was chemische Spezies (Atom oder Molekül) ist, die ein paar Elektronen eifrig aussieht. Das Wort bedeutet "Liebe zu Elektronen". Daher wird eine Elektrophie immer dazu neigen, bei der Teilnahme an chemischen Reaktionen Elektronen zu gewinnen oder zu akzeptieren.
Was macht ein Elektrophile, das Elektronen benötigt? Sie müssen einen Elektronenmangel haben, unabhängig davon. Das heißt, wir haben verschiedene Arten von Elektrophilen, obwohl sie alle Elektronenpaare negativer Spezies akzeptieren.
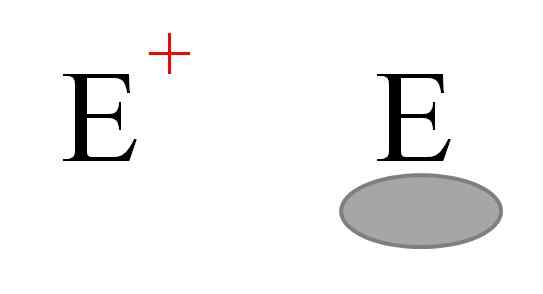 Die beiden häufigsten Arten von Elektrophilen in der Chemie. Quelle: Gabriel Bolívar.
Die beiden häufigsten Arten von Elektrophilen in der Chemie. Quelle: Gabriel Bolívar. Zwei Arten von Elektrophilen sind im Allgemeinen dargestellt. Beide sind mit dem Buchstaben symbolisiert und. Die links entspricht einer positiven Lastelektrophie und+. In der Zwischenzeit entspricht das rechts einem Elektrophilen mit elektronischer Leerstand, das durch ein graues Oval dargestellt wird, das das Fehlen von Elektronen in einem Orbital von Valencia anzeigt.
Metallkationen sind Beispiele für Elektrophile und+, sowie einige Polyiatomionen wie Hydronium, H3ENTWEDER+. Alhs Moleküle3 und bf3, Andererseits sind sie Beispiele für die zweite Art von Elektrophilen, da sowohl das Aluminium als auch das Boratom einen Elektronenmangel haben.
[TOC]
Reaktionen
Elektrophile reagieren, um Atomelektronenpaare mit hohen negativen Dichten zu akzeptieren, dh elektronen reichhaltig. Diese negativen Atome oder Moleküle werden als Nucleophile bezeichnet, Nu-, die ein paar Elektronen an die Elektrophie und e e spenden+:
Wellebeest- + UND+ → nu-e
Dies ist die theoretische Grundlage für viele organische Reaktionen, wie z. B. aromatische elektrophile Substitution. Das Nucleophil muss nicht unbedingt ein Anion sein, aber es kann auch ein neutrales Molekül mit einem elektronegativen Atom wie Stickstoff sein.
Kann Ihnen dienen: Silizium: Geschichte, Eigenschaften, Struktur, Erhalten, VerwendungenBeispiele für Elektrophile
Lewis -Säuren
Lewis -Säuren sind Elektrophile, weil sie per Definition Elektronenpaare akzeptieren. Metallische Kationen, mN+, Ziehen Sie die negativen Regionen der umgebenden polaren Moleküle in den Solvationsprozessen an. So, mN+ endet zu negativ.
Die GUCion Cu2+, Zum Beispiel ist es eine Lewis -Säure und ein Elektrophil2)62+. Ebenso wie es mit anderen Kationen passiert.
Nicht alle Lewis -Säuren sind Kationen: Einige sind neutrale Moleküle oder Atome. Zum Beispiel der BF3 Es ist eine Lewis -Säure und eine Elektrophile, weil.
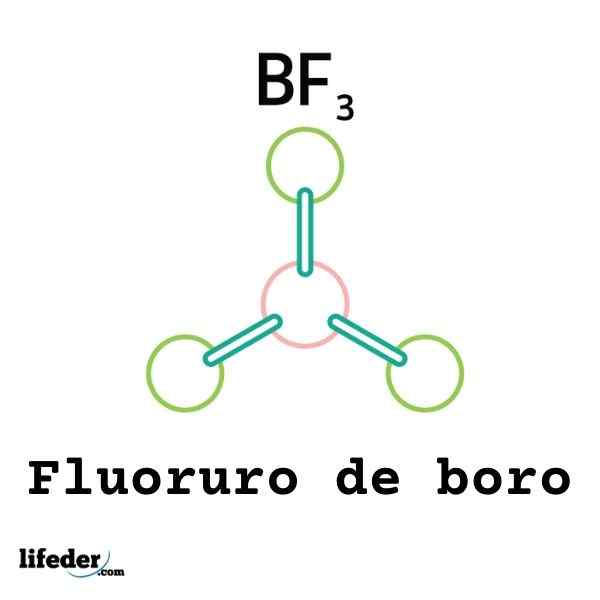
So wird es mit einem umgebenden Fluoridanion verbunden, um das Boro Tetrafluoruro -Anion, BF zu bilden4-. Das heißt, der Freund3 bildet einen Link mit dem f- durch Akzeptieren einiger ihrer Elektronen.
Eine andere Elektrophie ist Nitronio Ion, nein2+, die ein Elektrophylisches Mittel Sehr stark in den Nitrationsreaktionen von Benzol gebildet. In diesem Ion hat das Stickstoffatom eine positive Belastung, sodass die Benzolelektronen schnell akzeptieren.
Brönsted Säuren
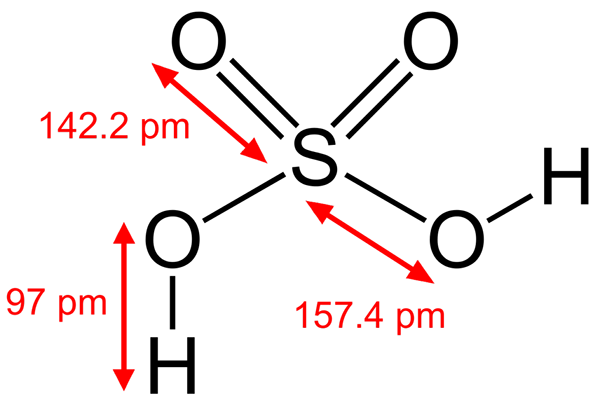 Schwefelsäurestruktur
Schwefelsäurestruktur Einige Brönsted -Säuren sind auch Elektrophile. Zum Beispiel das Hydroniumkation H3ENTWEDER+, Es ist ein Elektrophile, weil das Sauerstoffatom eine positive Belastung hat. Wenn Sie sehr elektronegativ sind, werden Sie versuchen, Elektronen zu gewinnen, die eines seiner Hydringen spenden, um sich in ein Wassermolekül zu verwandeln.
Eine andere Brönsted -Säure wie Schwefelsäure, H2SW4, Es ist auch ein Elektrophiler. Das Schwefelatom ist stark oxidiert und wird versuchen, Elektronen zu gewinnen, die seine beiden Wasserstoffe spenden.
Kann Ihnen dienen: Kohlenstofftetrachlor (CCL4)Halogene
Halogenen (f2, Cl2, Br2 und ich2) Sie sind Elektrophile. Seine Atome haben keine elektronischen Mängel; Ihre Verbindungen sind jedoch instabil, da sowohl Atome X-X Elektronen sehr stark anziehen.
Daher reagieren Halogene als Oxidationsmittel, verhalten sich als Elektrophile und akzeptieren Elektronenpaare, um Halogenidanionen zu werden (F-, Cl-, Br- und ich-).
Halogenen gewinnen jedoch nicht nur Elektronen auf diese Weise. Sie können auch mit weniger elektronegativen Atomen verbunden sein als sie, um einen Nettoelektronengewinn zu erzielen. Dies ist beispielsweise der Grund, warum sie zu den Doppelbindungen von Alkenen oder Olefinen hinzugefügt werden können.
Halogene repräsentieren eine andere Art von Elektrophie als die beiden, die zu Beginn eingeführt wurden. Das Verhalten am Ende ist jedoch das gleiche wie bei allen Elektrophilen: Elektronenpaare akzeptieren.
Miet- und Wasserstoffhalogenide
 CFC -Moleküle sind Alkylhalogenide
CFC -Moleküle sind Alkylhalogenide Miet- und Wasserstoffhalogenide sind Elektrophile, bei denen ein Halogen -Atom einen starken elektronischen Mangel aufweist, der durch das δ -Symbol dargestellt wird+. Dies liegt daran.
Für Alkylhalogenide wird Rx, R einen elektronischen Mangel haben, während x überschüssige Elektronen, rδ+-Xδ-. Wenn sich eine sehr negative Spezies RX nähert, greift sie R an, um damit zu verbinden und X als Anion herauszukommen lassen.
Außerdem hat Wasserstoff in Wasserstoffhalogeniden einen elektronischen Mangel oder eine positive Teilbelastung, hδ+-Xδ-. Daher erhalten negative Spezies diesem Wasserstoff ihre Elektronen und er akzeptiert sie als Elektrophile sie.
Carbonylverbindungen
Säuren, Halogene und Halogenide sind nicht die einzigen Moleküle, die als Elektrophile klassifiziert werden können. Auch wenn nicht, Kohlendioxid, co2, Es ist ein Elektrophilδ+= O.
Kann Ihnen dienen: Flacher HintergrundflascheDaher, wenn co - -2 Reacta wird es tun, um Elektronenpaare zu akzeptieren, entweder zum Carboxylat, zum Cooh -Gruppen oder zum Carbonatanion, Co32-.
Zusätzlich zu CO2, Carbonylverbindungen wie Ketone, Aldehyde und Ester sind ebenfalls Beispiele für Elektrophile, da in ihnen Kohlenstoff eine positive Teilbelastung aufweist und dazu neigt, Elektronen sehr negativer Spezies zu akzeptieren.
Karobokationen
 Methan -Kohlenstoff -Atom positiv geladen
Methan -Kohlenstoff -Atom positiv geladen Karobokationen sind außerordentlich starke Lewis -Säuren. Es gibt Tertiär (r3C+), sekundär (r2HC+) oder primär (RH2C+). Kohlenstoff bildet immer vier Bindungen.
Elektrophilie
Nicht alle Elektrophile sind von Elektronen genauso "hungrig". Einige sind reaktiver als andere. Je größer der elektronische elektrophile Mangel ist, desto größer ist seine Empfindlichkeit, nukleophile Angriffe negativer Spezies zu leiden. Das heißt, es wird eine größere Elektrophylität darstellen, was das relative Maß dafür ist, wie reaktiv der betreffende Elektrophile ist.
Zum Beispiel haben Carbokationen, Nitronium und Fluorid eine hohe Elektrophyläe; Während Kohlendioxid oder einige Kationen wie Natrium eine geringe Elektrophylacie aufweisen.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. 5. Ausgabe. Editorial Addison-Wesley Interamerikaner.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10. Ausgabe.). Wiley Plus.
- Wikipedia. (2020). Elektrophil. Abgerufen von: in.Wikipedia.Org
- James Ashenhurst. (2020). Nucleophile und Elektrophile. Erholt von: Masterorganicchemistry.com
- Professor Patricia Shaley. (2012). Nucleophile und Elektrophile. Universität von Illinois. Erholt von: Butan.Chem.UIUC.Edu
- Danielle Reid. (2020). Elektrophil: Definition & Beispiel. Lernen. Erholt von: Studium.com
- Tim Soderberg. (7. Oktober 2019). Elektrophile. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- « Biot-Savart-Rechtsformel, Demonstration, Bewerbungen, Übungen
- Das Toleranzgesetz von Shelford, was und Beispiele bestehen »

