Differentialelektron

- 1894
- 426
- Joe Hartwig
Er Differentialelektron o Differenzierer ist das letzte Elektron, das in der Abfolge der elektronischen Konfiguration eines Atoms platziert ist. Wie heissen Sie? Um diese Frage zu beantworten, ist es notwendig, die Grundstruktur eines Atoms zu kennen: seinen Kern, die Leere und die Elektronen.
Der Kern ist ein dichtes und kompaktes Aggregat positiver Partikel, die als Protonen bezeichnet werden, und neutrale Partikel, die als Neutronen bezeichnet werden. Die Protonen definieren die Atomzahl Z und bilden zusammen mit den Neutronen die Atommasse. Ein Atom kann jedoch nicht nur positive Gebühren tragen. Daher umkreisen die Elektronen um den Kern, um ihn zu neutralisieren.
 Basisatomstruktur: Hauptsubatompartikel der Hauptteile
Basisatomstruktur: Hauptsubatompartikel der Hauptteile Für jedes Proton, das den Kern ergänzt, wird ein neues Elektron in seine Orbitale eingebaut, um der wachsenden positiven Ladung entgegenzuwirken. Auf diese Weise steht das neue zugesetzte Elektron, das Differentialelektron, eng mit der Atomnummer Z in Verbindung.
Das Differentialelektron befindet sich in der äußersten elektronischen Schicht: der Valencia -Schicht. Je weiter der Kern ist, desto größer ist die damit verbundene Energie. Diese Energie ist für die Teilnahme sowie die der übrigen Valencia -Elektronen in den chemischen Reaktionen verantwortlich, die für die Elemente charakteristisch sind.
[TOC]
Quantenzahlen
Sowie der Rest der Elektronen kann das Differentialelektron durch seine vier Quantenzahlen identifiziert werden. Aber was sind die Quantenzahlen?? Sie sind "n", "L", "M" und "S".
Die Quantenzahl "N" bezeichnet die Größe des Atom- und Energieniveaus (K, L, M, N oder, P, Q). "L" ist die sekundäre oder arkale Quantenzahl, die die Form der Atomorbitale angibt und Werte von 0, 1, 2 und 3 für die Orbitale "S", "P", "D" und "F" angibt ", jeweils.
Es kann Ihnen dienen: Aphorated Flask: Eigenschaften, wofür es, Typen, verwendet, verwendet"M" ist die magnetische Quantenzahl und zeigt die räumliche Ausrichtung der Orbitale unter einem Magnetfeld an. Also 0 für das Orbital "S"; -1, 0, +1, für das Orbital "P"; -2, -1, 0, +1, +2, für das Orbital "D"; und -3, -2, -1, 0, +1, +2, +3 für das Orbital "F". Schließlich die Quantenzahl von Spin „S“ (+1/2 für ↑ und -1/2 für ↓).
Daher hat ein Differentialelektron die vorherigen Quantenzahlen ("N", "L", "M", "S") in Verbindung gebracht ("N", "L", "M", "S"). Da es der neuen positiven Belastung entgegenwirkt, die vom zusätzlichen Proton erzeugt wird, liefert es auch die Atomzahl Z des Elements.
Wie man das Differentialelektron kennt?
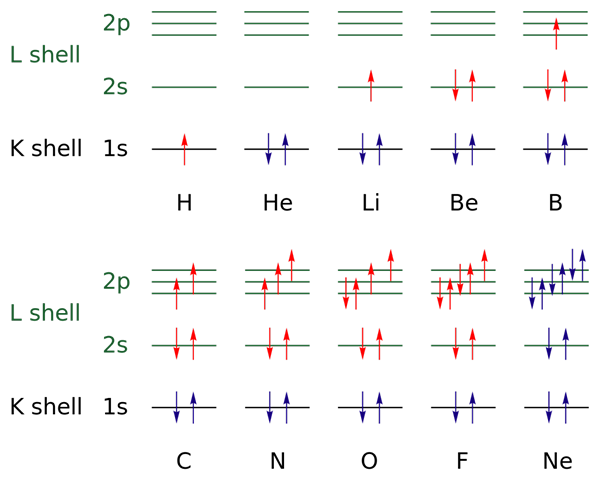
Im oberen Bild werden elektronische Konfigurationen für die Elemente von Wasserstoff zu Neongas dargestellt (H → NE).
Darin sind die Elektronen der offenen Schichten mit der Farbe Rot angezeigt, während die der geschlossenen Schichten mit der Farbe Blau angezeigt werden. Die Schichten beziehen sich auf die Quantenzahl "n", die erste der vier.
Auf diese Weise fügt die Valencia -Konfiguration des H (↑ von Rot) ein weiteres Elektron mit entgegengesetzter Orientierung hinzu, um die des HE (↓ ↑, beide blau, weil jetzt die Stufe 1 geschlossen ist). Dieses zusätzliche Elektron ist dann das Differentialelektron.
Somit kann beobachtet werden. Die Elektronen füllen die Orbitale, die die Sink -Regel und das Ausschlussprinzip von Pauling respektieren (perfekt von B bis zum NE beobachtet).
Und was ist mit Quantenzahlen?? Diese definieren jeden Pfeil - dh jedes Elektron - und seine Werte können mit der elektronischen Konfiguration bestätigt werden, um zu wissen, ob die des Differentialelektrons sind oder nicht.
Es kann Ihnen dienen: Was sind die negativen Auswirkungen, die wir auf die Wasserlöslichkeit haben?Beispiele für Differentialelektronen in mehreren Elementen
Chlor
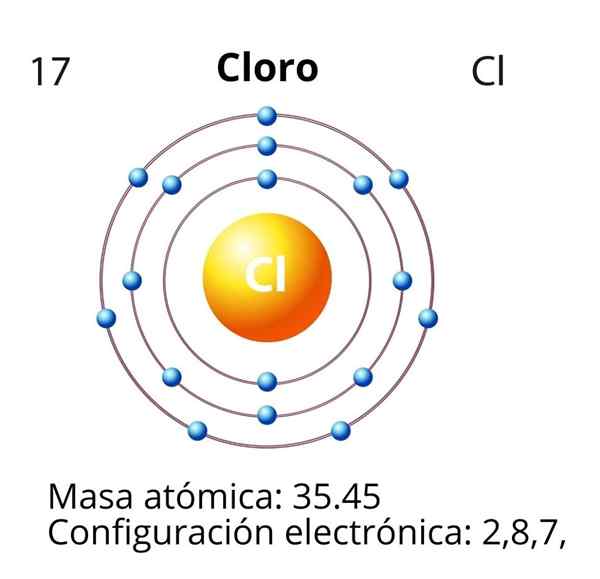
Im Fall von Chlor (CL) ist seine Atomzahl Z gleich 17. Die elektronische Konfiguration lautet dann 1s22s2sp63s23p5. Die rot markierten Orbitale entsprechen denen der Valencia -Schicht, die Level 3 offen zeigt.
Das Differentialelektron ist das letzte Elektron, das in der elektronischen Konfiguration platziert ist, und das Chloratom ist das des 3p -Orbitals, dessen Disposition wie folgt ist:
↑ ↓ ↑ ↓ ↑ _
3px 3py 3pz
(-1) (0) (+1)
In Bezug auf die Sink -Regel sind die 3p -Orbitale zuerst mit gleicher Energie gefüllt (ein Aufwärtspfeil in jedem Orbital). Zweitens passen die anderen Elektronen mit einsamen Elektronen von links nach rechts zusammen. Das Differentialelektron wird in einem grünen Rahmen dargestellt.
Somit hat das Differentialelektron für Chlor die folgenden Quantenzahlen: (3, 1, 0, -1/2). Das heißt, "n" ist 3; "L" ist 1, Orbital "P"; "M" ist 0, weil es das Orbital "P" des Mediums ist; Und "S" ist -1/2, da der Pfeil nach unten zeigt.
Magnesium
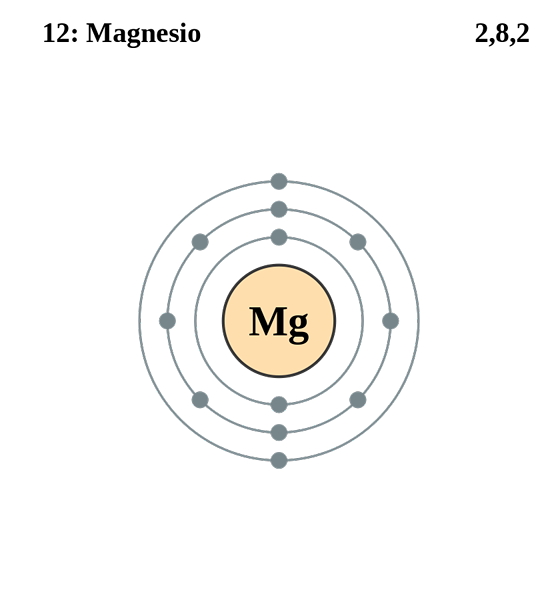 Elektronische Magnesiumkonfiguration. Quelle: Electron_shell_012_Magnesium.SVG: Pumbaa (Originalarbeit von Greg Robson) Derivative Arbeit: Kizar, CC BY-SA 3.0, über Wikimedia Commons
Elektronische Magnesiumkonfiguration. Quelle: Electron_shell_012_Magnesium.SVG: Pumbaa (Originalarbeit von Greg Robson) Derivative Arbeit: Kizar, CC BY-SA 3.0, über Wikimedia Commons Die elektronische Konfiguration für das Magnesiumatom beträgt 1s22s2sp63s2, Darstellung des Orbitals und des Valencia -Elektrons auf die gleiche Weise:
↑ ↓
3s
0
Diesmal hat das Differentialelektron Quantennummern 3, 0, 0, -1/2. Der einzige Unterschied in diesem Fall in Bezug auf das Chlor besteht darin, dass die Quantenzahl "L" 0 beträgt, weil das Elektron ein Orbital "S" (die 3S) einnimmt.
Zirkonio
Die elektronische Konfiguration für das Zirkoniumatom (Übergangsmetall) beträgt 1s22s2sp63s23p64s23d104p65s24d2. Ebenso lautet die Darstellung der Orbitale und Elektronen von Valencia wie folgt:
Es kann Ihnen dienen: Cyclopentano (C5H10): Struktur, Eigenschaften und Verwendung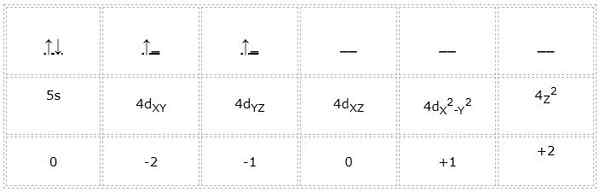
Somit sind die Quantenzahlen für das in Grün gekennzeichnete Differenzelektron: 4, 2, -1, +1/2. Hier, da das Elektron das zweite Orbital "D" einnimmt, hat es eine Quantenzahl "m" gleich -1. Auch weil der Pfeil aufsteigt, ist seine Spinzahl "S" gleich +1/2.
Unbekanntes Element
Die Quantenzahlen des Differentialelektrons für ein unbekanntes Element sind 3, 2, +2, -1/2. Was ist die Atomzahl Z des Elements?? Zu wissen, Z kann entschlüsseln, was das Element ist.
Diesmal bedeutet dies, wie "n" dieselbe 3 ist, dass sich das Element in der dritten Periode der Periodenzüchter befindet und "D" -Dorbitale als Valencia -Schicht ("L" gleich 2). Daher werden Orbitale wie im vorherigen Beispiel dargestellt:
↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
Die Quantenzahlen "m" gleich +2 und "s" gleich -1/2 ist der Schlüssel, um das Differentialelektron im letzten 3D -Orbital korrekt zu lokalisieren.
Das gesuchte Element hat also 3D -Orbitale10 voll, wie seine internen elektronischen Schichten. Zusammenfassend ist das Element Metallzink (Zn).
Die Quantenzahlen des Differentialelektrons können jedoch nicht zwischen Zink und Kupfer erkennen, da dieses letzte Element auch 3D -Orbitale voll darstellt. Weil? Weil Kupfer ein Metall ist, das aus Quantengründen mit den Regeln von mit Elektronen fehlgeschlagen ist.
Verweise
- Jim Branson. (2013). Sinks Regeln. Abgerufen von Quantummechanics.UCSD.Edu
- Vorlesung 27: Die Regeln von Sink's Regeln. Von ph.Qmul.AC.Vereinigtes Königreich
- Purdue Universität. Quantennummern und Elektronenkonfigurationen. Von Mured abgerufen.Chem.Purdue.Edu
- Salvat -Enzyklopädie der Wissenschaft. (1968). Salvat Physik, s.ZU. von Pamplona Editions, Band 12, Spanien, S. 314-322.
- Walter J. Moore. (1963). Physikalische Chemie. In Partikel und Wellen. Vierte Ausgabe, Longmans.

