Kalomel -Elektrodenbetrieb, Eigenschaften, verwendet

- 679
- 9
- Medine Kedzierski
Er Kalomelelektrode o Calomelanes ist eine sekundäre Elektrode, mit der dank der Reaktion zwischen Quecksilber und Quecksilberchlorid (I), HG, die Halbzeitpotentiale bestimmen können2Cl2, früher als Calomel bekannt. Beide Reagenzien, HG und Hg2Cl2, Sie gewinnen oder verlieren Elektronen, je nach dem Medium, in das die Elektrode eingetaucht ist.
Normalerweise ersetzt diese Elektrode in vielen Messungen an der Standard -Wasserstoffelektrode (She), da sie leichter zu bauen und weniger riskant zu manipulieren (trotz Quecksilber. Innen enthält eine KCL -Lösung als Elektrolytmedium für den Elektronenfluss.
 Kalomelelektrode in voller Messung. Quelle: Chandrajit Karmakar, CC BY-SA 4.0, über Wikimedia Commons
Kalomelelektrode in voller Messung. Quelle: Chandrajit Karmakar, CC BY-SA 4.0, über Wikimedia Commons Calomel -Elektrode kann je nach Größe oder wichtigerer KCL -Konzentration unterschiedliche Varianten aufweisen. Wenn die KCL -Lösung gesättigt ist, sprechen wir über ein Elektro von Saturado Calomel (ESC) über ein Elektro. Der ESC ist leichter vorzubereiten als die EG, aber empfindlicher gegenüber Temperaturänderungen.
Die Verwendung dieser Elektrode hat es ermöglicht, die Halblebenspotentiale für unzählige Redoxreaktionen zu bestimmen. Es handelt sich auch um ein wiederkehrendes Gerät in potentiometrischen Bestimmungen, die die Menge an Analyten abhängig von der Zelle und dem gemessenen Potential kennenlernen möchten.
[TOC]
Funktion
So dass die Elektrode von Calomel funktioniert, das HG-HG-Paar2Cl2 Sie müssen reagieren, egal ob Gewinnen oder Verlust von Elektronen.
Kathodisch
Wenn die Verringerung oder Gewinne von Elektronen in der Kalomelelektrode auftritt, haben wir die folgenden Reaktionen:
Hg2Cl2 → hg22+ + 2cl- (Ionisation)
Hg22+ + 2e- → 2Hg (Reduktion)
Hg2Cl2 + 2e- → 2Hg +2cl- (Nettoreaktion)
Kann Ihnen dienen: exotherme ReaktionDaher die Hg2Cl2 Gewinnen Sie Elektronen, die sich auf Metallic Quecksilber reduzieren.
Das Potential E der Elektrode, wenn die Reduktion auftritt, wird durch die Gleichung angegeben:
E = eº - 0.0591 log [cl-]
Wo beobachtet wird, dass es ausschließlich von der Konzentration der Cl -Ionen abhängt-, Das Standard -Reduktionspotential für diese gemessene Elektrode vor der Standard -Wasserstoffelektrode ist.
Anodisch
Innerhalb der Elektrode kann auch ein Oxidationsprozess auftreten:
2Hg → Hg22+ + 2e- (Oxidation)
Hg22+ + 2cl- → hg2Cl2 (Niederschlag)
2Hg +2cl- → hg2Cl2 + 2e- (Nettoreaktion)
Das heißt, dass Quecksilber oxidiert, um mehr Hg zu erzeugen2Cl2.
Das potenzielle e in diesem Fall wird gegeben durch:
E = eº + 0.0591 log [cl-]
Und wieder, und es hängt von [Cl ab-].
Allgemeine Reaktion
Die allgemeine Reaktion für Calomels Elektrode lautet:
Hg2Cl2(s) + 2e- ⇌ 2Hg (l) + 2cl-
Das Gleichgewichtssinn hängt von dem Medium ab, in dem die Elektrode in Kontakt ist. Das Cl- Bestimmen Sie die Löslichkeit von Hg2Cl2, was wiederum einen Einfluss auf die Bildung oder Oxidation des Hg hat.
Und das Potential für eine bestimmte Konzentration von Cl -Ionen bestimmt- Es wird gleich sein:
UNDKalomel = ENetz - UNDOchse
EKalomel Das Potenzial, das in bestimmten potenziellen Tabellen als Referenz gemeldet wird.
Eigenschaften der Kalomelelektrode
Darstellung des Semi
Calomel Electrodes Semi -Dedge kann wie folgt dargestellt werden:
Pt | Hg | Hg2Cl2| Cl- (Xm)
Wo nur die Konzentration von Cl -Ionen wichtig ist-, exprimiert in Molarität oder Normalität. Das potenzielle E der Elektrode variiert, wenn sie mit Lösungen verschiedener KCL -Konzentrationen gefüllt ist.
Zum Beispiel eine EC mit KCL 0.1 m hat a und gleich 0.3356 V bei 25 ° C; Während der ESC mit gesättigter KCL eins und gleich 0 hat.2444 V bei der gleichen Temperatur.
Kann Ihnen dienen: Isopentano: Struktur, Eigenschaften, Verwendungen, ErhaltenDaher ist die KCL -Konzentration das wichtigste Merkmal von Kalomelelektroden, da sie angibt, was zu verwenden ist, wenn die Berechnungen der potentiometrischen Messungen durchgeführt werden.
Kommerziell werden drei Arten von Kalomelelektroden erreicht: gesättigt (ESC), der neunzehnte (0).1 n oder 0.1 m kcl) und die Normalen (1 n oder 1 m kcl). Eine Elektrode von Kalomel 1 m kcl würde als:
Pt | Hg | Hg2Cl2| Cl- (1 m)
Partys
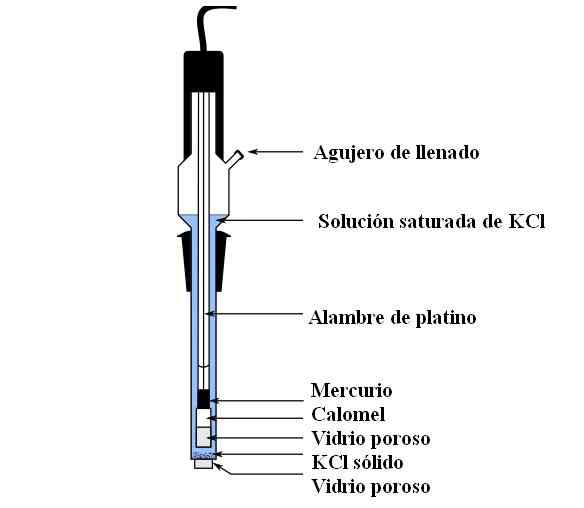 Kalomel -Elektrodenteile. Quelle: Bachi-Bouzou, CC0, über Wikimedia Commons
Kalomel -Elektrodenteile. Quelle: Bachi-Bouzou, CC0, über Wikimedia Commons Im oberen Bild zeigen wir die Hauptteile einer gewöhnlichen Kalomelelektrode. Es besteht aus Glas und besteht aus zwei Behältern: einem externen, der in elektrochemischer Kontakt mit dem Medium der Messungen gestellt wird und die KCL -Lösung enthält; Und eine innere, wo die Hg-Hg-Mischung ruht2Cl2.
Innen enthält die Kalomelelektrode flüssiges Quecksilber, auf der eine Hg -Paste eingehalten wird2Cl2 mit Quecksilber angefeuchtet. Dies ist die aktivste Phase der Elektrode. Das poröse Glas wird verwendet, um nur den Eintritt oder den Ausgang der Cl -Ionen zuzulassen-, Aber nicht die Kristalle von HG2Cl2 oder Quecksilbertropfen.
Ein Platinkabel, bei dem die Elektronen fließen, wird in Quecksilber getaucht und ist dafür verantwortlich, die Elektrode mit dem Voltmeter und dem betreffenden externen Schaltkreis anzuschließen.
Durch die Füllloch. In der Zwischenzeit haben wir am Boden der Elektrode eine sehr kleine Öffnung in einem porösen Glas, das direkt mit dem Medium der Messungen in Kontakt kommt. Der Zweck des porösen Glass ist es, Kontakt ohne unerwünschte Austausch von Substanzen zuzulassen, die die Elektrode oder die Probe kontaminieren.
Es kann Ihnen dienen: Cyclohexen: Struktur, Eigenschaften, Synthese und VerwendungVorteile
Die Calomel -Elektrode bietet die folgenden Vorteile in Bezug auf die Standard -Wasserstoffelektrode:
-Leicht zu bauen und zu manipulieren
-Sein Zellpotential bleibt konstant, selbst wenn das Wasser verdunstet
-Sie brauchen keine Salzbrücke
Der ESC ist am einfachsten aus Calomel -Elektroden zu bauen, da KCL ausreicht, um sich aufzulösen, bis ihre Kristalle gebildet sind. Dann ist die Lösung gesättigt und bereit, in die Elektrode abzuschütteln.
Nachteile
Calomels Elektrode zeigt jedoch die folgenden Nachteile:
-Durch das Einhalten von flüssigem Quecksilber kann es einen negativen Einfluss auf die Umwelt ausüben
-Es kann nicht für quantitative Analysen in Proben mit einer Temperatur von mehr als 60 ° C verwendet werden, da der HG2Cl2 beginnt zu zerbrechen und führt dazu, dass Elektrodenmesswerte scheitern
Der ESC hat auch den Nachteil, dass er sehr empfindlich gegenüber Temperaturänderungen ist.
Silbersilberelektrode hat das Kalomel in vielen der potentiometrischen Bestimmungen ersetzt.
Anwendungen
Die Calomels Elektrode ist eine der vielen Elektroden, die täglich in potentiometrischen Bestimmungen verwendet werden, um die halb -Life -Potentiale von Analyten oder Arten von Interesse zu erhalten.
Außerdem wird die Kalomelelektrode bei pH -Messungen und zyklischer Voltmetrie verwendet.
Verweise
- Tag, r., & Underwood, a. (1986). Quantitative analytische Chemie (Fünfter Aufl.). Pearson Prentice Hall.
- Wikipedia. (2020). Gesättigte Kalomelelektrode. Abgerufen von: in.Wikipedia.Org
- Allgemein, eni. (20. Oktober 2018). Elektrodenkalomel. Kroatisch-englische Chemie-Wörterbuch & Glossar. Ktf-split. 30. Oktober. 2020. Erholt von: Glossar.Periodni.com
- Skoog d.ZU., West d.M. (1986). Instrumentalanalyse. (Zweite Ed.). Inter -American., Mexiko.
- Hügel, g., Ives, d. T. (1950). Die Kalomelelektrode. Natur 165, 530 doi.org/10.1038/165530a0
- JMGAV. (9. Dezember 2012). Potentiometrie (ii): Elektroden. Abgerufen von: Triplenlace.com
- « Sozio -kritische Paradigmeneigenschaften, Methoden, Vertreter
- Potentiometrie -Grundlagen, Gleichungen, Elektroden »

