Referenzelektrodeneigenschaften, Funktion, Beispiele
- 4198
- 811
- Nick Laurén
Er Referenzelektrode Es ist ein Gerät, das in der potentiometrischen und voltamétrischen Analyse zur quantitativen Bestimmung eines Analyten verwendet wird. Seine Bedeutung ist, wie der Name schon sagt, als Verweis zu dienen, um den tatsächlichen Wert des Potentials bei der Reaktion eines elektrochemischen Semi -Elk abzuschätzen.
Die Potentiale eines Semi -Media hängen von der Interessenkonzentration ab, da es durch Gewinnen oder Verlust von Elektronen reagiert. Auf diese Weise ist es möglich, ihre Konzentration durch diese Potentiale zu bestimmen. Ihre Werte sind jedoch nicht absolut, sondern in Bezug auf die Standard -Wasserstoffelektrode (sie in Englisch).
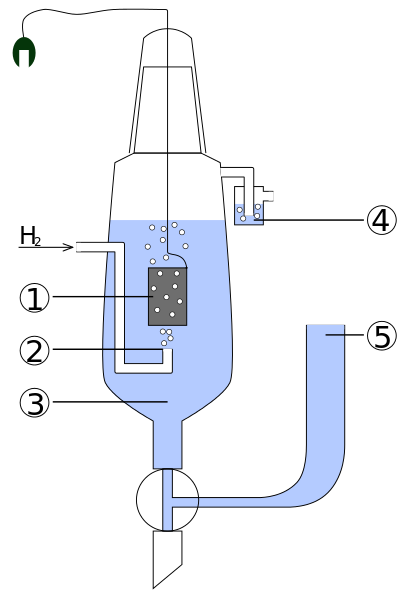
 Diagramm der Teile eines Standard -Wasserstoff -Elektros. Quelle: Standard_hydrogen_elecrod.JPG: Kaverinderivevative Arbeit: Henry Muelpfordt/CC BY-S (http: // CreateRecommons.Org/lizenzen/by-sa/3.0/)
Diagramm der Teile eines Standard -Wasserstoff -Elektros. Quelle: Standard_hydrogen_elecrod.JPG: Kaverinderivevative Arbeit: Henry Muelpfordt/CC BY-S (http: // CreateRecommons.Org/lizenzen/by-sa/3.0/) Durch Konvent. Das Problem ist, dass diese Elektroden schwer zu manipulieren sind, sodass sie nicht praktikabel sind, sie in allen Analysen zu installieren. Hier treten Referenzelektroden ein, viel einfacher und dessen Potenzial von 0V unterscheidet.
Einige der Referenzelektroden, wie z. B. die gesättigte Elektrode (ESC) von Calomel. Ebenso werden sie offen auf dem Markt mit ihren richtigen Spezifikationen erhalten, und die Risiken der Kontamination der Stichprobe des Analyten sind minimal.
[TOC]
Referenzelektrodeneigenschaften
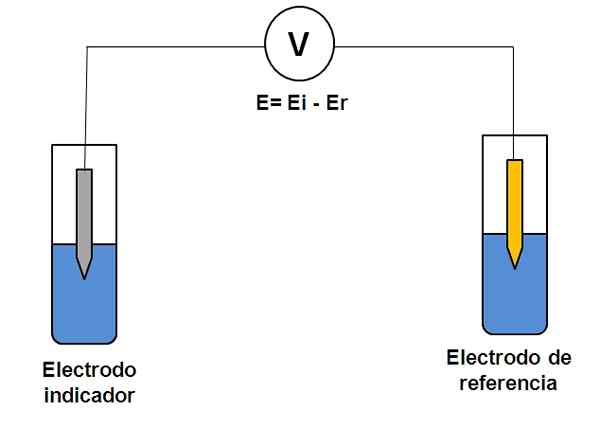 Einfache Darstellung eines zwei Elektrodensystems in der Potentiometrie. Quelle: Gabriel Bolívar.
Einfache Darstellung eines zwei Elektrodensystems in der Potentiometrie. Quelle: Gabriel Bolívar. Betrachten Sie das obige Elektrodensystem. Einer ist der Indikator (grau), bei dem die Reaktion von Interesse stattfindet, und der andere ist die Referenz (Gold). Diese Elektrochemie-Zelle wird ein Potential haben und, was gleich der Differenz der Potentiale beider Elektroden (EI-E) entspricht. Daher muss jede Variation in E auf das Potential der Indikatorelektrode zurückzuführen sein.
Kann Ihnen dienen: Kaliumcyanid (KCN): Eigenschaften, Verwendungszwecke, Strukturen, Risiken,Aus dem obigen Abschluss wird der Schluss gezogen, dass die Referenzelektrode die folgenden Eigenschaften aufweist:
-Es hat während der Zeit ein stabiles Potenzial und ist reproduzierbar. Das heißt, es sollte gleich sein, unabhängig davon, wo oder wie oft die Messungen durchgeführt werden.
-Seine chemische Zusammensetzung ist konstant und unempfindlich, sodass sie kaum Veränderungen unterzogen wird, wenn sie mit der Lösung des Analyten interagiert oder sich in ein wässriges Medium taucht.
-Im Gegensatz zur Standard -Wasserstoffelektrode ist es einfach zu bauen und zu montieren, die die Verwendung eines Wasserstofftanks erfordert und Explosionsrisiken ausführt.
Die Indikatorelektrode ist eine, die empfindlich gegenüber der Konzentration des Analyten ist.
Referenzelektrodenfunktion
Referenzelektrodenpotentiale werden an der Standard -Wasserstoffelektrode gemessen, sodass sich ihre Werte von 0V unterscheiden. Dank dieser Wasserstoffelektroden ist die Konstruktion der Standardpotentabellen der Standard- und º.
In der Praxis wird jedoch nicht überall eine Wasserstoffelektrode beladen. Stattdessen werden Referenzelektroden verwendet, viel einfacher und sicher zu manipulieren.
Da seine Potentiale konstant und stabil sind, sind die potenziellen Messwerte der Elektrochemiezelle ausschließlich auf die Indikatorelektrode zurückzuführen. Das heißt, zu den Variationen der Konzentration des betreffenden Analyten.
Daher besteht die Referenzelektrodenfunktion darin, das Potential jeder Reaktion in einem der Halbverliere des elektrochemischen Systems zu bestimmen. Wenn ihre Potentiale nicht stabil wären, wären die quantitativen Bestimmungen des Analyten nicht zuverlässig. Jede potentiometrische oder voltametrische Analyse sollte angeben, welche Referenzelektrode sie verwendet haben, um ihre Ergebnisse zu melden.
Es kann Ihnen dienen: Bromous Säure (Hbro2): physikalische und chemische Eigenschaften und verwendet und verwendetReferenzelektroden Beispiele
Es gibt mehrere verfügbare Referenzelektroden auf dem Markt. Einige werden für sehr spezifische Bestimmungen verwendet. Es gibt jedoch zwei Elektroden unter allen, die dank ihrer Einfachheit und Praktikabilität hervorheben: die Calomel-Elektrode und Silber-Silberklorlorid, beide in vielen potentiometrischen und voltamletischen Analysen sehr wiederkehrend.
Kalomelelektrode
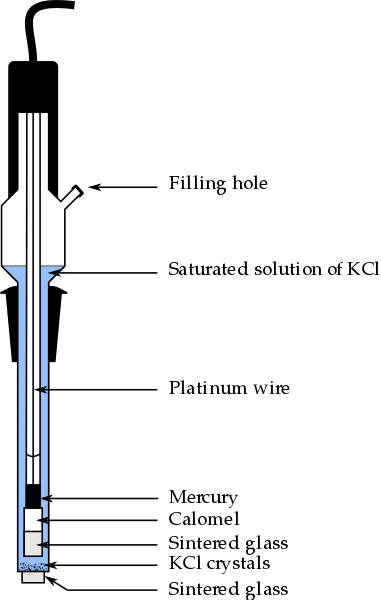 Teile der Kalomelelektrode, eines der am häufigsten verwendeten Referenzelektroden in der analytischen Chemie. Quelle: Bachi-Bouzouk über Wikipedia.
Teile der Kalomelelektrode, eines der am häufigsten verwendeten Referenzelektroden in der analytischen Chemie. Quelle: Bachi-Bouzouk über Wikipedia. Im oberen Bild sind die herkömmlichen Teile einer gesättigten Kalomelelektrode gezeigt, ECS. Es wird gesagt, dass es gesättigt ist, weil es eine gesättigte Lösung von KCL (blau) enthält, die auch abgewackelt ist.
Die interne Säule, die mit einem Platindraht reist, ist mit Quecksilber gefüllt, was wiederum eine Kalomelpaste hg angeht, HG2Cl2 o Quecksilberchlorid (I) und die gesättigte Lösung von KCL. Somit ist in dieser Elektrode die Konzentration der Cl -Ionen wichtig-, da sein Wert das Potenzial der Elektrode modifiziert.
Die Reaktion, die stattfindet, lautet wie folgt:
Hg2Cl2(s) + 2e- - ⇌ 2Hg (l) + 2cl- -
Und es hat ein eº von 0.241 V.
Am unteren Ende des ECS befindet sich ein poröser Brat, der in elektrischen Kontakt mit der Lösung des Analyten aufgenommen wird und den kontrollierten Austausch von Ionenionen ermöglicht-. Andernfalls würde es eine Kontamination von Chloriden in der Probe geben, und auch die Elektrode würde ihre kostbare gesättigte KCL -Lösung verlieren.
Diese Elektrode wird für pH -Messungen und im Allgemeinen jedes Analyten verwendet, dessen Konzentration in einem wässrigen Medium bestimmt werden kann.
Es kann Ihnen dienen: thermischer Alkohol: Struktur, Eigenschaften, Risiken und VerwendungSilber Silberelektrode
 Silber Silber Elektro. Quelle: TenoFallTrade (Diskussion) (Uploads). / Public Domain
Silber Silber Elektro. Quelle: TenoFallTrade (Diskussion) (Uploads). / Public Domain Ähnlich wie bei der Calomels Elektrode besteht die Silbersilberelektrode aus einem mit Silberchlorid bedeckten Silberdraht und auch in eine Lösung, die durch ein Gemisch aus KCL und AgCL gesättigt ist.
Alle Teile sind in einem Kunststoffrohr geschützt, der eine poröse Öffnung hat, durch die es elektrischen Kontakt mit der Lösung herstellt.
Die Reaktion, die ihr Potential definiert, eº = 0.197 V, ist wie folgt:
Agcl (s) + e- - ⇌ ag (s)+cl- -
Diese Elektrode weist größere Verwendungen und Präferenzen auf als die von Calomel, was auf die negativen Auswirkungen von Quecksilber auf die Umwelt zurückzuführen ist. Andererseits sind silberfolle Silberelektroden einfacher, sicher und billig im Labor zu bauen.
Wir sagen dann, dass die Silberschnabelelektrode in vielen ihrer Anwendungen Calomels ersetzt (potenzentiometrische Abschlüsse, Korrosionstests, elektrochemische Analyse usw.).
Es ist auch eine der bevorzugten Optionen in Biologie und Medizin, insbesondere für Elektrokardiographie und Elektroenzephalographie, da Silber oder sein Salz relativ giftige Substanzen für den Körper sind.
Verweise
- Tag, r., & Underwood, a. (1965). Quantitative analytische Chemie. (Fünfter Aufl.). Pearson Prentice Hall.
- Skoog d.ZU., West d.M. (1986). Instrumentalanalyse. (Zweite Ed.). Inter -American., Mexiko.
- Wikipedia. (2020). Elektrodenreferenz. Abgerufen von: in.Wikipedia.Org
- Elsevier b.V. (2020). Elektrodenreferenz. Scientedirect. Abgerufen von: Scientedirect.com
- Chemistry Librettexts. (9. Juni 2020). Referenzelektroden. Erholt von: Chem.Librettexts.Org
- « Alexandria Lighthouse Location, Geschichte, Beschreibung, Ruinen
- Emily Dickinson Biographie, Erfolge, Werke, Phrasen »

