Starkes Elektrolytkonzept, Eigenschaften, Beispiele

- 2329
- 257
- Tizian Liebich
A Starker Elektrolyt Es ist all diese Substanz, die sich in Wasser oder in einem bestimmten Lösungsmittel aufgelöst hat, von Ionen vollständig dissoziiert. Daher sollte es keine Lösung als neutrale Moleküle oder als unlösliche Feststoffe geben. Ein starker Elektrolyt kann ein Salz, eine Säure oder eine Base sein, vorausgesetzt, sie dissoziieren oder vollständig ionisch.
Das repräsentativste Beispiel für einen Elektrolyten ist häufig Salz, Natriumchlorid, NaCl. In wässriger Lösung dissoziieren NaCl -Kristalle in ihrer Gesamtheit, NA -Ionen zu produzieren+ und Cl-, das landet die umgebenden Wassermoleküle. Es wird dann gesagt, dass sich ein Salz wie ein starker Elektrolyt verhält, wenn seine Löslichkeit sehr hoch ist.
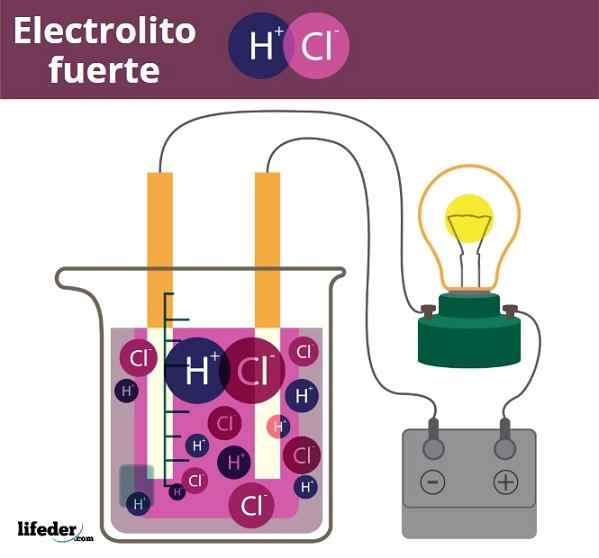 Fuero Electrolite Beispiel. HCl, Salzsäure, H3O+ und Cl -Ionen freisetzten sich-
Fuero Electrolite Beispiel. HCl, Salzsäure, H3O+ und Cl -Ionen freisetzten sich- Etwas ähnlich ist der Fall von Säuren und Basen. Wenn diese stark sind, erzeugen ihre Lösungen im Wasser die maximal mögliche Menge an H -Ionen3ENTWEDER+ oder oh-, Die pH -Veränderungen sind also abrupt. Beispiele für starke Säuren und Basen sind Salpetersäure, HNO3, bzw. Kaliumhydroxid, Koh.
Es ist wichtig zu wissen, wie man starke Elektrolyte identifiziert.
[TOC]
Eigenschaften starker Elektrolyte
Löslichkeit
Starke Elektrolyte sind durch extrem lösliche Wassersubstanzen gekennzeichnet. Ob fest oder Gase, wenn es mit Wasser in Kontakt kommt, sollte es nicht zu viel verzögert werden, um sich vollständig aufzulösen. Wenn zum Beispiel ein Salz in Wasser wenig löslich ist, kann sie als starker Elektrolyt verworfen werden.
Ionische Leitfähigkeit
Starke Elektrolyte sind nicht nur sehr löslich im Wasser, sondern erzeugen auch eine große Anzahl von Ionen. Dank der elektrischen Gebühren dieser Ionen können Elektronen die Lösungen bequem bewegt. Dies spiegelt sich in einer Zunahme der ionischen Leitfähigkeit in Bezug auf reines Wasser wider. Deshalb führen ionische Lösungen einen sehr guten Strom an.
Kann Ihnen dienen: Chlor: Geschichte, Eigenschaften, Struktur, Risiken, verwendetKochsalzlösung
Viele salzhaltige starke Elektrolyte, die beim Auflösen in Wasser keine pH -Veränderung erzeugen. Dies bedeutet, dass die Lösungen dieser Salze nicht sauer oder grundlegend, sondern neutral sind, mit einem pH -Wert nahe 7.
Es kann jedoch saure oder grundlegende Salze geben, die leicht in Wasser gelöst werden können und die auch vollständige Ionen erzeugen. Zum Beispiel Natriumcarbonat2CO3, löst sich auf, um NA -Ionen zu erzeugen+ und co32-, Aber der pH -Wert der Lösung ist grundlegend.
Beispiele für starke Elektrolyte
 Natriumchlorid ist das repräsentativste Beispiel für einen starken Elektrolyten. Quelle: Cristian V. /Cc by-sa (https: // creativecommons.Org/lizenzen/by-sa/4.0)
Natriumchlorid ist das repräsentativste Beispiel für einen starken Elektrolyten. Quelle: Cristian V. /Cc by-sa (https: // creativecommons.Org/lizenzen/by-sa/4.0) Starke Elektrolyte, die so viele sind, sind in drei Klassifikationen unterteilt: starke Säuren, starke Basen und lösliche Salze Produkte von Neutralisationen zwischen den ersten beiden.
Starke Säuren
Starke Säuren beim Auflösen in Wasser ohne Probleme müssen die maximal mögliche Menge von H erzeugen3ENTWEDER+, So muss Säure vollständig ion sein; Das heißt, es sollte nicht als neutrales Molekül mit Säureprotonen existieren, ohne freizumachen.
Beispiele für diese Säuren sind:
-HCl, Salzsäure, freisetzt H -Ionen3ENTWEDER+ und Cl-
-HF, Fluorhorsäure, freisetzt H -Ionen3ENTWEDER+ und f-
-Hno3, Salpetersäure, Freisetzung Hones H3ENTWEDER+ und nicht3-
-HCLO4, Perklorsäure, freisetzt Hionen3ENTWEDER+ und clo4-
-HIO4, Periódinsäure, freisetzt H -Ionen3ENTWEDER+ und io4-
-H2SW4, Schwefelsäure, Freisetzung Hones H3ENTWEDER+ Und so42-
Der Grund, warum das Hydrium -Ion, h3ENTWEDER+, Es ist immer vorhanden (auf die eine oder andere Weise), es liegt daran, dass der Wasserstoff, den sie spenden, von einem Wassermolekül empfangen wird:
HCl + H2O → h3ENTWEDER+ + Cl-
Die Reaktion ist direkt und irreversibel. Dies ist ein Merkmal einer starken Säure, was wiederum ein starker Elektrolyt aufgrund ihrer vollen Ionisation im Wasser ist.
Kann Ihnen dienen: Aliphatische Kohlenwasserstoffe: Eigenschaften, Nomenklatur, Reaktionen, TypenStarke Grundlagen
Starke Grundlagen, die sich ohne Probleme in Wasser auflösen, müssen OH -Ionen freisetzen- Aus den gleichen Kristallen oder einer irreversibel Unstörheit eines Wassermoleküls, um sie zu erzeugen.
Viele starke Grundlagen bestehen aus Ionen- und nicht molekularen Festkörpern. Einige Beispiele für diese Basen, die sich als starke Elektrolyte verhalten, sind:
-Lioh, Lithiumhydroxid, freisetzt OH -Ionen- und li+
-NaOH, Natriumhydroxid, freisetzt OH -Ionen- und na+
-Rboh, Rubidio Hydroxid, veröffentlicht OH -Ionen- und rb+
-CA (OH)2, Calciumhydroxid, Freisetzung von OH -Ionen- und ca2+
-SR (OH)2, Strontiumhydroxid, Freisetzung von OH -Ionen- und MR2+
-Ba (oh)2, Bariumhydroxid, Freisetzung von OH -Ionen- und ba2+
-Nah, Natriumhydrid, freisetzt OH -Ionen- und Wasserstoffgas, h2
-Nanh2, Natriummasturo, Freisetzung von OH -Ionen- und Ammoniakgas, NH3
Du gehst raus
Hallrobasi starke Elektrolyte beim Auflösen in Wasser müssen vollständig ion sein. Viele von ihnen produzieren keine pH -Veränderungen. Dies liegt daran. Beispiele für diese Salze sind:
-NaCl, Natriumchlorid, freisetzt Na -Ionen+ und Cl-
-Agno3, Silbernitrat, AG -Ionen freigeben+ und nicht3-
-Älterer Bruder3, Natriumnitrat, nationale Ionen freisetzen+ und nicht3-
-K2SW4, Kaliumsulfat, freisetzt K Ionen+ Und so42-
-Mgcl2, Magnesiumchlorid, mg Ionen frei2+ und Cl-
-Cuso4, Cupric -Sulfat, freisetzt Ionen Cu2+ Und so42-
-KBR, Kaliumbromid, freisetzt K Ionen+ und Br-
-NH4CL, Ammoniumchlorid, freisetzt NH -Ionen4+, Cl-, H3ENTWEDER+ und Ammoniakgas
Es kann Ihnen dienen: Quecksilberchlorid (ii): Struktur, Eigenschaften, erhalten, verwendet, verwendet-NACN, Natriumcyanid, freisetzt Na -Ionen+ und cn-
-N / A3Po4, Natriumphosphat, freisetzt Na -Ionen+ und po43-
-CRCL3, Chromchlorid, veröffentlicht CRIONs3+ und Cl-
-Aub3, Auric Bromid, veröffentlicht Au -Ionen3+ und Br-
-Snso4, Estany Sulfat, setzt SN -Ionen frei2+ Und so42-
Der NH4CL ist ein widersprüchliches Beispiel: Es ist vollständig ionisiert, aber gleichzeitig erzeugt es ammoniakneutrale Moleküle, weil es ein Säuresalz ist.
Unterschiede zwischen starkem und schwachem Elektrolyt
Obwohl die Unterschiede zwischen einem starken Elektrolyten eines schwachen indirekt festgelegt wurden, werden diese nachstehend als Schlussfolgerung dargestellt:
-Starke Elektrolyte sind in Gewässern sehr löslich; Schwache Elektrolyte sind nicht.
-Die Ionisation eines schwachen Elektrolyten ist teilweise, was bedeutet, dass es in Lösung neutrale Moleküle geben kann. Stattdessen existieren starke Elektrolyte ausschließlich als Ionen.
-Die schwachen Säuren und Basen, die wiederum schwache Elektrolyte sind, dissoziieren sich nicht vollständig im Wasser, so dass sie weniger Ionen H erzeugen3ENTWEDER+ oder oh- Was konnte erwartet werden.
-Die starken Elektrolyte von Halthalin sind im Vergleich zu schwachen Elektrolyten fast nicht hydrolysiert. Daher sind die Lösungen der ersteren tendenziell neutral, außer wenn sie sich mit Säure- oder Basissalzen befassen.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Starker Elektrolyt. Abgerufen von: in.Wikipedia.Org
- Helmestine, Anne Marie, ph.D. (11. Februar 2020). Starke Elektrolytdefinition und Beispiel. Erholt von: thoughtco.com
- Chung & Chieh. (5. Juni 2019). Elektrolyte. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- « Externe Bewertungseigenschaften, Typen (Tests), Beispiele
- Platonbiographie, Philosophie und Beiträge »

