Elektronegativität
- 3025
- 4
- Timo Rabenstein
Was ist Elektronegativität?
Der Elektronegativität Es ist eine relative periodische Eigenschaft, die die Fähigkeit eines Atoms betrifft, die elektronische Dichte seiner molekularen Umgebung anzuziehen. Dies ist der Trend eines Atoms, um Elektronen für sich selbst anzulocken. Dies spiegelt sich im Verhalten vieler Verbindungen und wie intermolekular miteinander interagieren.
Mit anderen Worten, je elektronegativer es ein Atom ist, desto größer ist die Fähigkeit, Elektronen anderer Atome anzuziehen. Es wird auch ein höheres Ionisationspotential haben, mit dem Sie Ihre Elektronen angesichts der äußeren Anziehung aufrechterhalten und gleichzeitig Elektronen der umgebenden Atome anziehen können.
Jetzt ziehen nicht alle Elemente Elektronen benachbarter Atome in gleichem Maße an. Im Falle derer, die eine elektronische Dichte ergeben, wird gesagt, dass sie es sind elektropositiv, Während diejenigen, die Elektronen "abdecken", sind Elektronegative. Es gibt viele Möglichkeiten, diese Eigenschaft (oder das Konzept) zu erklären und zu beobachten.
Zum Beispiel in den Karten elektrostatischer Potentiale für ein Molekül (wie das Chlordioxid des überlegenen Bildes, CLO2) Die Wirkung der verschiedenen Elektronegativitäten auf Chlor- und Sauerstoffatome wird beobachtet.
Die rote Farbe zeigt die Bereiche an, die reich an Elektronen des Moleküls, Δ- und die blaue Farbe, die schlecht von Elektronen sind, Δ+. Nach einer Reihe von Rechenberechnungen kann diese Art von Karten festgelegt werden; Viele von ihnen zeigen eine direkte Beziehung zwischen der Position elektronegativer Atome und Δ-.
Es kann auch wie folgt sichtbar gemacht werden: In einem Molekül ist es wahrscheinlicher, dass der Elektronentransit in der Nähe der elektronegativsten Atome auftritt.
Aus diesem Grund für die CLO2 Sauerstoffatome (rote Kugeln) sind von einer roten Wolke umgeben, während Chloratom (die grüne Kugel) einer bläulichen Wolke.
Die Definition der Elektronegativität hängt von dem Ansatz des Phänomens ab. Es gibt mehrere Skalen, die es aus verschiedenen Aspekten betrachten. Alle Skalen haben jedoch gemeinsam, dass sie durch die intrinsische Natur von Atomen unterstützt werden.
Elektronegativitätskalen
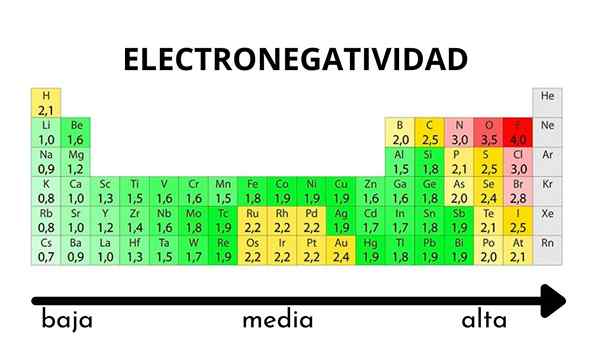
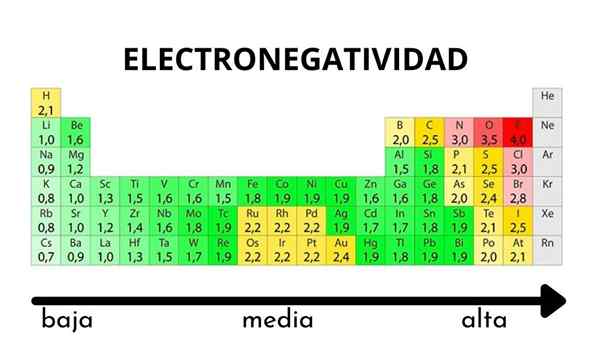 In der Periodischtisch kann beobachtet werden, wenn der Wert der Elektronegativität zunimmt oder abnimmt
In der Periodischtisch kann beobachtet werden, wenn der Wert der Elektronegativität zunimmt oder abnimmt Elektronegativität ist weder eine Eigenschaft, die quantifiziert werden kann, noch hat sie absolute Werte. Dies liegt daran. Mit anderen Worten: Die Elektronegativität variiert je nach Molekül.
Wenn für das CLO -Molekül2 Das Atom von CL wird in die N geändert, dann würde die Tendenz des oder der Anziehung der Elektronen ebenfalls modifiziert; Es könnte erhöht werden (die Redst -Wolke erhalten) oder abnehmen (Farbe verlieren). Der Unterschied würde in der neuen N-O-Verbindung liegen, um das O-N-O-Molekül zu haben (Stickstoffdioxid, nein2).
Es kann Ihnen dienen: Verhältnis von Chemie und Technologie zu Menschen, Gesundheit und UmweltDa die Elektronegativität eines Atoms für alle molekularen Umgebungen nicht gleich ist, muss es nach anderen Variablen definiert werden. Auf diese Weise gibt es Werte, die als Referenz dienen und die eine Vorhersage ermöglichen, beispielsweise die Art der gebildeten Verbindung (ionisch oder kovalent).
Paulingskala
Der große Wissenschaftler und Gewinner von Two Nobel Awards, Linus Pauling (1901-1994), die 1932 eine quantitative (messbare) Form der Elektronegativität, bekannt als Pauling-Skala. Darin war die Elektronegativität von zwei Elementen A und B, die Verbindungen bildeten.
Theoretisch sind die kovalenten Bindungen am stabilsten, da die Verteilung ihrer Elektronen zwischen zwei Atomen gerecht ist; Das heißt, für die A-A- und B-B-Moleküle haben beide Atome die Bindungselektronen auf die gleiche Weise. Wenn A jedoch elektronegativer ist, wird das Paar mehr als von B sein.
In diesem Fall ist A-B nicht mehr vollständig kovalent, obwohl sich die Elektronegativität nicht wesentlich unterscheidet, kann gesagt werden, dass seine Verbindung einen hohen kovalenten Charakter hat. In diesem Fall erfährt die Verbindung nur eine geringe Instabilität und erwirbt zusätzliche Energie als Produkt des Elektronegativitätsunterschieds zwischen A und B.
Je größer dieser Unterschied ist, desto mehr die Energie der A-B-Verbindung und desto größer ist der ionische Charakter der Link.
Diese Skala stellt die am häufigsten verwendete Chemie dar, und die Werte der Elektronegativitäten sind aus der Zuordnung eines Wertes von 4 für das Fluoratom hervorgegangen (das Element mit der niedrigsten Elektronegativität ist Cesium mit 0,7). Von dort aus konnten sie die der anderen Elemente berechnen.
Mulliken Skala
Während die Pauling-Skala mit der mit den Verbindungen verbundenen Energie zu tun hat, hängt die Robert Mulliken-Skala (1896-1986) eher mit zwei anderen periodischen Eigenschaften zusammen: Ionisation Energy (EI) und elektronische Affinität (AE).
Ein Element mit hohen Werten von EI und AE ist daher sehr elektronegativ und wird daher Elektronen aus seiner molekularen Umgebung anziehen.
Weil? Weil es widerspiegelt, wie schwierig es ist, ein externes Elektron zu "starten" und wie stabil das in einer Gasphase gebildete Anion ist. Wenn beide Eigenschaften hohe Größen aufweisen, ist das Element "Liebhaber" von Elektronen.
Kann Ihnen dienen: FusionMulliken Electronegativitäten werden mit der folgenden Formel berechnet:
ΧM = ½ (ei + ae)
Das heißt χM Es entspricht dem Durchschnittswert von EI und AE.
Im Gegensatz zu der Pauling -Skala, die davon abhängt, welche Atome Links bilden, hängt dies mit den Eigenschaften des Zustands Valencia zusammen (mit seinen stabilsten elektronischen Konfigurationen).
Beide Skalen erzeugen ähnliche Elektronegativitätswerte für die Elemente und beziehen sich ungefähr auf die folgende Umwandlung:
ΧP = 1.35 (χM)1/2 - 1.37
Beide xM als xP Sie sind dimensionslose Werte; Das heißt, ihnen fehlen Einheiten.
Skala von a.L. Allred und e. Rochow
Es gibt andere Skalen der Elektronegativität wie Sanderson und Allen. Der, der den ersten beiden folgt, ist jedoch die Allred- und Rochow -Skala (χAr). Diese Skala basiert auf der effektiven Kernbelastung, die ein Elektron auf der Oberfläche der Atome erfährt. Daher hängt es direkt mit der attraktiven Kraft des Kerns und dem Screeneffekt zusammen.
Wie variiert die Elektronegativität in der Periodenzüchtertabelle?
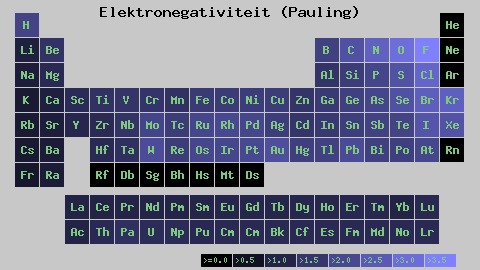 Pauling Electronegativity Scale. Quelle: Wikimedia Commons
Pauling Electronegativity Scale. Quelle: Wikimedia Commons Unabhängig von den Skalen oder Werten, die sie hat, steigt die Elektronegativität für einen bestimmten Zeitraum von rechts nach links und von unten nach oben in den Gruppen. Somit steigt es in Richtung der oberen rechten Diagonal (nicht das Helium zählen), bis der Fluor ist.
Im überlegenen Bild sagten die Frisch. In der Periodenzüchter werden Pauling -Elektronegativitäten gemäß den Farben der Kisten ausgedrückt. Da Fluorid am elektronegativsten ist, liegt es an einer rauen lila Farbe, während die weniger elektronegativen (oder elektropositiven) Farben dunkler.
Es ist auch zu sehen, dass Gruppenköpfe (h, be, b, c usw.) Sie haben die klarsten Farben und da die Gruppe von den anderen Elementen abstammt. Um was geht es hierbei? Die Antwort ist wieder in den Eigenschaften EI, AE, ZEF (effektive Kernbelastung) und im Atomradius.
Das Atom im Molekül
Einzelne Atome haben ein echtes nukleares Z und externe Elektronen erleiden ein wirksames Kernlastprodukt der Abschirmungseffekt.
Wenn es sich über einen bestimmten Zeitraum bewegt, nimmt ZEF so zu, dass das Atom erfasst wird. Das heißt, Atomradios werden während eines Zeitraums reduziert.
Dies führt dazu, dass zum Zeitpunkt der Verknüpfung eines Atoms mit einem anderen die Elektronen mit einem größeren ZEF zum Atom "fließen". Dies verleiht der Verbindung einen ionischen Charakter, wenn es einen deutlichen Trend von Elektronen gibt, um zu einem Atom zu gehen. Wenn nicht, gibt es die Rede von einer überwiegend kovalenten Bindung.
Kann Ihnen dienen: violettes GlasAus diesem Grund variiert die Elektronegativität je nach Atomradios ZEF, was wiederum eng mit EI und AE zusammenhängt. Alles ist eine Kette.
Nützlichkeit der Elektronegativität
Die Elektronegativität dient im Prinzip, zu bestimmen, ob eine binäre Verbindung kovalent oder ionisch ist. Wenn die Elektronegativitätsdifferenz sehr hoch ist (in der Geschwindigkeit von 1.7 Einheiten oder mehr) Es wird gesagt, dass die Verbindung ionisch ist.
Es ist auch nützlich, in einer Struktur zu erkennen, die Regionen möglicherweise in Elektronen reicher sind.
Von hier aus kann vorhergesagt werden, welcher Mechanismus oder Reaktion die Verbindung leiden kann. In armen Regionen von Elektronen, Δ+, ist es möglich, dass negativ geladene Spezies auf eine bestimmte Weise erhalten; Und in den in Elektronen reichhaltigen Regionen können ihre Atome auf sehr spezifische Weise mit anderen Molekülen (Dipol-Dipolo-Wechselwirkungen) interagieren.
Beispiele (Chlor, Sauerstoff, Natrium, Fluorid)
Was sind die Elektronegativitätswerte für Chlor-, Sauerstoff-, Natrium- und Fluoratome? Nach Fluorid, der am elektronegativsten ist? Unter Verwendung des periodischen Tisches wird beobachtet, dass Natrium eine dunkelviolette Farbe hat, während Sauerstofffarben und Chlor visuell sehr ähnlich sind.
Ihre Elektronegativitätenwerte für die Skalen von Pauling, Mulliken und Allred-Rhow sind:
Na (0.93, 1.21, 1.01).
Oder (3.44, 3.22, 3.fünfzig).
Cl (3.16, 3.54, 2.83).
F (3.98, 4.43, 4.10)).
Beachten Sie, dass es bei numerischen Werten einen Unterschied zwischen den Negativitäten von Sauerstoff und Chlor gibt.
Nach der Mulliken-Skala ist Chlor elektronegativer als Sauerstoff, im Gegensatz zu Pauling- und Allred-Rhochow-Skalen. Der Unterschied in der Elektronegativität zwischen beiden Elementen ist unter Verwendung der Allred-Rhow-Skala noch deutlicher. Und schließlich ist Fluorid, unabhängig von der gewählten Skala, die elektronegativste.
Wenn es ein Atom von F in einem Molekül gibt, bedeutet dies daher, dass die Verbindung einen hohen ionischen Charakter hat.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition., P. 30 und 44). Mc Graw Hill.
- Jim Clark. (2000). Elektronegivität. Entnommen aus: Chemguide.CO.Vereinigtes Königreich
- Anne Marie Helmestine, ph.D. (11. Dezember 2017). Definition und Beispiel der Elektronegaten. Genommen von: thoughtco.com
- Markus e. Tuckerman. (5. November 2011). Elektronegatenskala. Genommen von: NYU.Edu
- Wikipedia (2018). Elektronegativität. Genommen von: Es ist.Wikipedia.Org

