Interne Elektronen
- 3999
- 658
- Ivan Pressler
Wir erklären, was interne Elektronen sind, ihre Eigenschaften und geben mehrere Beispiele an
Was sind interne Elektronen?
Wenn wir an ein Atom denken, stellen wir uns vor.
Aber nicht alle Elektronen sind gleich und zwei Klassen können unterschieden werden, je nachdem, wie nah oder weit sie vom Atomkern stammen.
Einige sind weiter vom Kern entfernt und werden als Valencia -Elektronen bezeichnet. Diese sind für alle chemischen Reaktionen verantwortlich, die wir kennen. Andererseits, Diejenigen, die dem Kern am nächsten sind und stärker damit vereint sind, sind diejenigen, die wir als interne Elektronen bezeichnen.
Eigenschaften interner Elektronen
Sie sind die stabilsten Elektronen
In der Regel ist dies in der Regel stabiler, je niedriger der Energieniveau eines Elektrons. Interne Elektronen belegen Orbitale mit den niedrigsten Energieniveaus eines Atoms. Daher sind sie auch die stabilsten Elektronen.
Sie sind stärker mit dem Kern vereint
Der Kern zieht Elektronen an, weil beide entgegengesetzte Lasten haben: Der Kern ist positiv, während negative Elektronen. Diese Kraft steigt mit abnimmt, wenn die Entfernung abnimmt.
Infolgedessen sind interne Elektronen, die dem Kern am nächsten stehen, auch diejenigen, die am stärksten mit demselben verbunden sind. Aus dem gleichen Grund sind sie auch die schwierigsten Elektronen, die zu entfernen sind.
Sie sind nicht Teil der chemischen Bindungen
Wenn sich ein Atom einem anderen nähert, sind die äußersten Elektronen das erste, was zu berühren ist. Aus diesem Grund gehen nur Valencia -Elektronen in chemische Reaktionen ein. Interne Elektronen und beteiligen sich nicht an chemischen Bindungen, noch sind sie an einer chemischen Reaktion beteiligt.
Es kann Ihnen dienen: Wie viele Custain -Elektronen hat Carbon?Sie schützen sehr
Dies bedeutet, dass interne Elektronen zwischen externen Elektronen und dem Kern stehen und eine Art Screen erzeugen, der die Kraft reduziert, mit der der Kern die Elektronen der Valenz anzieht.
Sie kommen immer paarweise
In jedem Orbital gibt es nur zwei Elektronen mit entgegengesetzten Spins, die als gepaarte Elektronen bezeichnet werden (was eine andere Art zu sagen ist, dass sie ein Paar bilden). Wie die Orbitale, in denen sich interne Elektronen befinden, sind sie immer vollständig voll, sodass diese Elektronen immer gepaart sind.
Woher wissen wir, wie viele interne Elektronen ein Atom hat??
Zu wissen, wie viele interne Elektronen ein Atom haben, ist sehr einfach. Sie müssen nur wissen, wie viele Elektronen das Atom hat und wie viele dieser Elektronen zur Valencia -Schicht gehören. Alle anderen Elektronen sind interne Elektronen.
Aber wie finden wir diese Zahlen heraus?? In den folgenden Abschnitten erklären wir es.
Die Gesamtzahl der Elektronen entspricht der Atomzahl
Da die Atome neutral sind (dh sie haben keine elektrische Netto -Ladung), müssen sie die gleiche Anzahl von positiven Lasten (Protonen) wie negative Belastungen (Elektronen) haben. Da die Atomzahl angibt, wie viele Protonen sich im Kern befinden.
Bei Ionen, die im Gegensatz zu Atomen eine elektrische Ladung haben, wird die Gesamtzahl der Elektronen erhalten, indem die Atomzahl mit Ausnahme der Ionenlast mit allem und ihrem Zeichen subtrahiert.
Beispiele
- Das Kohlenstoffatom (c) ist Elementnummer 6 der Periodenzüchter (dh seine Atomzahl). Daher hat das Kohlenstoffatom insgesamt 6 Elektronen.
- Das Natriumion (i) (na+) hat eine positive Ladung von +1 und die Atomzahl von Natrium beträgt 11. Die Gesamtzahl der Elektronen dieses Ions ist also: 11 - (+1) = 10 Elektronen.
- Das Chloridion (CL)-) hat eine negative Belastung von -1 und die Atomzahl von Chlor ist 17. Die Gesamtzahl der Elektronen dieses Ions ist also: 17 - ( - 1) = 17 + 1 = 18 Elektronen.
Die Anzahl der Elektronen von Valencia entspricht ihrer Gruppe in der Periodenzüchtertabelle
Die Elemente, die zu Gruppe 1A (den alkalischen Metallen) gehören, haben alle 1 Elektronen von Valencia. Diejenigen, die zum 2. (Alkaliner) gehören, haben 2, die des 3. (Boro Group, Aluminium, Gallium usw.) Sie haben 3 und so weiter. Dies gilt nicht für Übergangsmetalle.
Wie zuvor werden die Ionen von der Berechnung ihrer Valenzelektronen abgezogen.
Beispiele
- Sauerstoff gehört zur Gruppe 6A für die 6 Valenzelektronen.
- Die Sulfidionen (s)2-) Es gehört auch zur Gruppe 6a, hat aber eine Last von -2, so dass es: 6 -( -2) = 6 + 2 = 8 Valencia -Elektronen hat.
Beispiele für verschiedene Atome und ihre inneren Elektronen
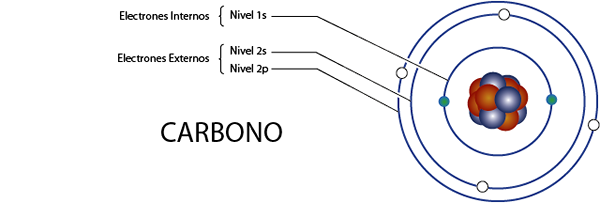
Innere Kohlenstoffelektronen (c)

Wie wir vor einem Moment gesehen haben, hat Carbon insgesamt 6 Elektronen. Außerdem gehört es zu Gruppe 4A für die 4 Elektronen Valencia, so dass es insgesamt 6 - 4 = hat 2 interne Elektronen.
Interne Stickstoffelektronen (n)
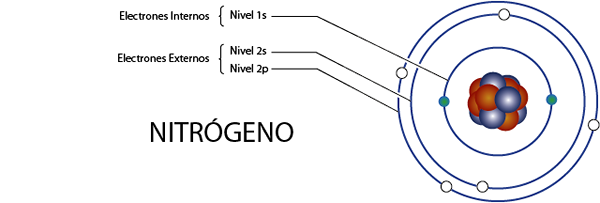
Stickstoff hat insgesamt 7 Elektronen. Darüber hinaus gehört es zu Gruppe 5A für die 5 Elektronen Valencia, so dass es insgesamt 7 - 5 = hat 2 interne Elektronen.
Interne Elektronen von Argon (AR)
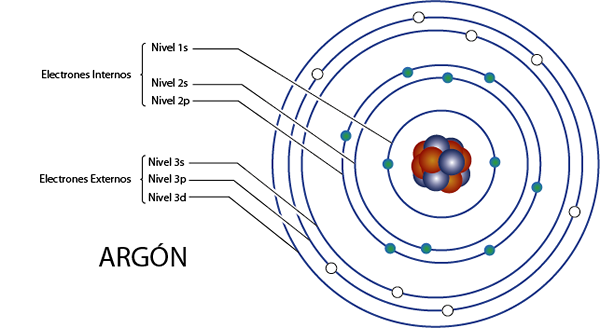
Argon ist Element 18 für insgesamt 18 Elektronen. Außerdem gehört es zu Gruppe 8A für die 8 Elektronen Valencia, so dass es insgesamt 18 - 8 = hat 10 interne Elektronen.
Innere Elektronen des Chloridionen (CL)-)
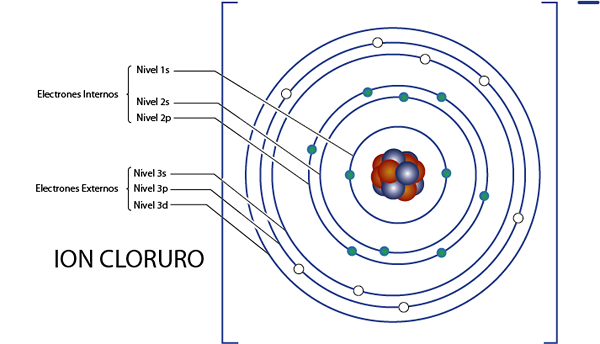
Wie wir vor einem Moment gesehen haben, hat Chlorid insgesamt 18 Elektronen. Außerdem gehört es zu Gruppe 7a und hat Last -1, so dass es 7 - ( - 1) = 8 Valencia -Elektronen hat. Es hat also 18 - 8 = 10 interne Elektronen, Wie Argon.
Es kann Ihnen dienen: Kernchemie: Geschichte, Studienbereich, Bereiche, AnwendungenInterne Elektronen von Calcium +2 Ion (ca2+)
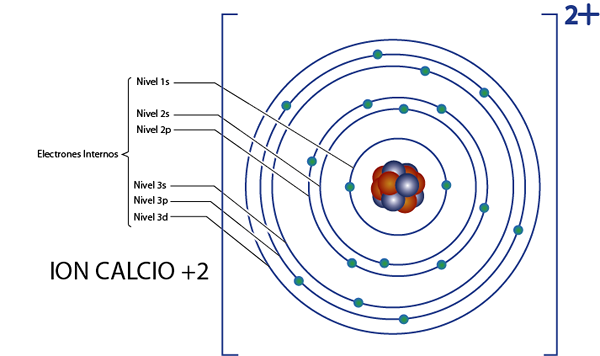
Kalzium ist Element 20, und dieses Ion hat 2 positive Ladungen, so dass es insgesamt insgesamt hat 20 - 2 = 18 Elektronen um den Kern. Dieses Element gehört zu Gruppe 2A und da seine Last +2 ist, hat es keine Valenzelektronen (2 - 2 = 0). Aus diesem Grund waren alle 18 von Kalzium hinterlassenen Elektronen ursprünglich die internen Elektronen.
Es gibt zwei Elemente, die keine internen Elektronen haben
Die beiden leichteren Elemente des Periodenzüchtertabels, die Wasserstoff (H) und Helium (HE) sind, haben nur 1 bzw. 2 Elektronen. Beide Elektronen sind auf dem einzigen Energieniveau, den diese Atome haben, was Stufe 1 ist.
Aus diesem Grund entsprechen diese Elektronen den Valenzelektronen dieser beiden Elemente. Da es keine niedrigeren Energieniveaus gibt, gibt es auch keine internen Elektronen.

