Aktivierungsenergie

- 4733
- 681
- Rieke Scheer
Wir erklären, was die Aktivierungsenergie, ihre Formel, Einheiten, wie sie berechnet wird, und wir geben mehrere Beispiele an
Was ist Aktivierungsenergie?
Der Aktivierungsenergie (UNDZu) Es ist definiert als die minimale Energie, die für eine chemische Reaktion erforderlich ist. Mit anderen Worten, es ist die Energiebarriere, die überwunden werden muss, damit Reagenzien zu Produkten werden können.
Aktivierungsenergie ist im täglichen Leben im Einsatz zu sehen. In der Tat wissen wir alle, dass beim Öffnen des Gaspassage -Schlüssels in der Küche nicht sofort verbrannt wird, wenn er mit der Luft in Kontakt kommt.
Damit die Verbrennungsreaktion beginnt, ist es notwendig, einen Funken oder das Feuer eines Spiels zu liefern. Dieser Funke oder dieses Feuer repräsentiert die Aktivierungsenergie der Verbrennungsreaktion.
Warum ist eine Aktivierungsenergie erforderlich??
Um den Grund zu verstehen, warum Reaktionen eine minimale Energie erfordern, ist es wichtig zu verstehen, wie sie auftreten. Damit zwei Atome oder Moleküle reagieren müssen, müssen sie zuerst kollidieren. Außerdem müssen sie es mit der richtigen Ausrichtung tun, damit neue chemische Bindungen gebildet werden können und die alten Menschen brechen können.
Selbst wenn die beiden Moleküle mit der perfekten Ausrichtung aufeinander gerichtet sind, stellt dies nicht sicher, dass eine wirksame Kollision aufgrund der Abstoßung zwischen den Elektronen der Oberfläche der Moleküle angegeben wird.
Aus diesem Grund ist es erforderlich.
Diese minimale kinetische Energie, die auf mikroskopischer Ebene erforderlich ist.
Kann Ihnen dienen: Lithiumbromid: Struktur, Eigenschaften, Verwendungsmöglichkeiten, RisikenWas in einem Energiediagramm zu sehen ist?
Ein Energiediagramm ist eine grafische Darstellung, die zeigt, wie die Energie der Reagenzien variiert, wenn sie in Produkte umgewandelt werden. In diesen Diagrammen, wie sie unten präsentiert werden, ist es leicht zu sehen und zu interpretieren, Aktivierungsenergie.

In dieser Grafik zeigt die blaue Linie die Energie im Laufe der Reaktion. Hier können Sie sehen, dass die Reagenzien, um die Produkte zu werden, zuerst einen Hügel überwinden müssen, um den Übergangszustand zu erreichen. Andernfalls werden sie in ihren Anfangszustand zurückgegeben.
Die Höhe dieses Hügels ist genau die Aktivierungsenergie. Wenn es möglich ist, zu überwinden, ist der Rest der Straße bergab und die Reagenzien werden schnell zu den Produkten.
Aktivierungsenergieeinheiten
Aktivierungsenergie ist eine intensive Größe, die in Energieeinheiten über Masse oder Maulwürfe ausgedrückt wird. Da es unterschiedliche Energieeinheiten und unterschiedliche Masseneinheiten gibt, kann Aktivierungsenergie in verschiedenen Einheiten ausgedrückt werden. Die meisten in der Chemie am häufigsten verwendeten sind:
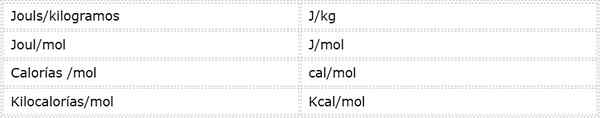
Welche Einheit verwendet wird.
Aktivierungsenergieformel
Aktivierungsenergie hängt mit der Reaktionsgeschwindigkeit zusammen. Je größer die Aktivierungsenergie ist, desto niedriger die Geschwindigkeit. Diese Beziehung wird mathematisch durch die Arrhenius -Gleichung ausgedrückt, die die Geschwindigkeitskonstante einer Reaktion auf die Temperatur bezieht.
Kann Ihnen dienen: Benedict Reagenz: Wofür ist es, Komponenten, Vorbereitung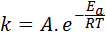
In dieser Gleichung, k Es ist die Geschwindigkeitskonstante der Reaktion undZu Es ist die Aktivierungsenergie, R ist die Konstante der idealen Gase, t ist die absolute Temperatur und wird als Arrhenius-Präexponentialfaktor bezeichnet, der auch als Kollisionsfaktor bezeichnet wird.
Diese Gleichung kann neu angeordnet werden, um zu geben:
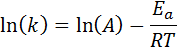
Wenn der Wert von A für die Reaktion bekannt ist, kann die Aktivierungsenergie durch Löschen der vorherigen Gleichung erhalten werden. Dies ist jedoch nicht die Art und Weise, wie die Aktivierungsenergie einer Reaktion normalerweise bestimmt wird. Normalerweise wird die Geschwindigkeitskonstante bei zwei oder mehr Temperaturen bestimmt, was es unnötig macht, es zu wissen.
Wie wird die Aktivierungsenergie berechnet??
Aktivierungsenergie wird aus den Werten der Geschwindigkeit konstant bei verschiedenen Temperaturen bestimmt. Mindestens zwei Werte von k gemessen bei verschiedenen t -Werten zur Berechnung der Aktivierungsenergie ohne zu wissen, was normalerweise der Fall ist.
Abhängig davon, wie viele Werte von k Sie haben, können Sie berechnen undZu In zwei Wegen:
1. Wenn du. .. hast k bei zwei Temperaturen
In diesen Fällen ist es einfacher, von der ersten Form der Arrhenius -Gleichung aus zu beginnen. Wenn wir anrufen k1 zur Geschwindigkeit konstant bei Temperatur T1 Und k2 zur Geschwindigkeit konstant bei Temperatur T2, Dann können wir die Arrhenius -Gleichung zweimal schreiben:
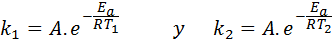
Jetzt können wir jede der beiden Gleichungen zwischen den anderen teilen, um a:
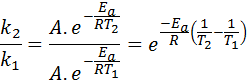
Dann nehmenZu, wird erhalten:
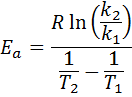
2. Wenn du. .. hast k mehr als zwei Temperaturen
In Fällen, in denen bei verschiedenen Temperaturen mehrere Bestimmungen der Geschwindigkeit konstant sind, ist es vorzuziehen, die Aktivierungsenergie grafisch oder durch lineare Regression zu finden. Dies basiert auf der Gleichung in logarithmischer Form, die die Form einer Linie hat:
Es kann Ihnen dienen: Clausius-Clapeyron-Gleichung: Wofür es, Beispiele, Übungen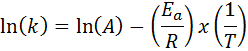
Wenn wir ein Diagramm von ln (k) gegen (1/t) erstellen, erhalten wir eine gerade Linie, die an der Achse schneidet Und in ln (a) und deren Steigung ist gleich -(e)Zu/R). Von dort wird die Aktivierungsenergie erhalten.
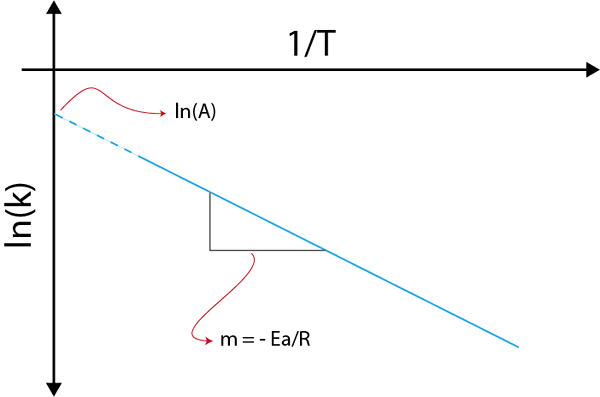 Arrhenius -Diagramm zur Bestimmung der Aktivierungsenergie
Arrhenius -Diagramm zur Bestimmung der Aktivierungsenergie Beispiele für die Berechnung von Aktivierungsenergien
Beispiel 1
Die Geschwindigkeitskonstante einer ersten Orderreaktion wurde bei zwei verschiedenen Temperaturen bestimmt. 298 K hatte einen Wert von 0.058 s-1, Während bei 350 K stieg der Wert auf 0,425 s-1. Bestimmen Sie die Aktivierungsenergie dieser Reaktion in j/mol.
- Lösung: Da Sie die Konstante bei zwei Temperaturen haben, kann die oben gezeigte Aktivierungsenergieformel direkt verwendet werden. Da die Energie in J/Mol -Einheiten angefordert wird, müssen wir die Gaskonstante in diesen Einheiten verwenden:
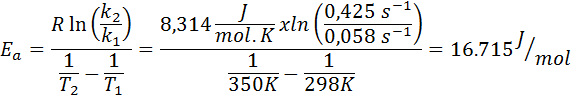
Beispiel 2
Die Geschwindigkeitskonstante für eine chemische Reaktion der zweiten Ordnung wird bei verschiedenen Temperaturen gemessen. Die Werte sind in der folgenden Tabelle dargestellt. Bestimmen Sie die Aktivierungsenergie in kcal/mol.
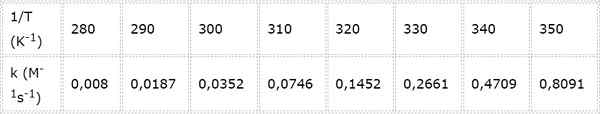
- Lösung: Wie in diesem Fall gibt es mehrere Temperaturen, es ist vorzuziehen, die Aktivierungsenergie grafisch zu bestimmen. Da.
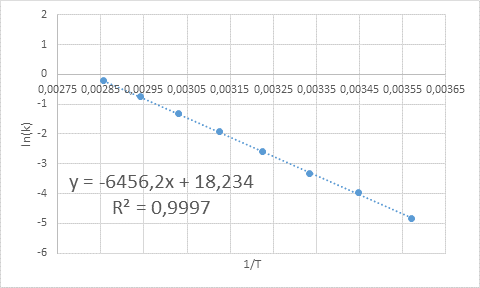 Beispiel für die grafische Bestimmung der Aktivierungsenergie
Beispiel für die grafische Bestimmung der Aktivierungsenergie Aus der in der Grafik gezeigten Gleichung der Leitung wird die Steigung erhalten, die -6456.2 beträgt. Da ist die Steigung (m) gleich - eZu/R, dann:
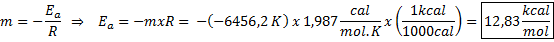
Das heißt, die Aktivierungsenergie dieser Reaktion beträgt 12,83 kcal/mol.

