Ionisationsenergie

- 4736
- 889
- Said Ganzmann
Was ist Ionisierungsenergie?
Der Ionisationsenergie, Dargestellt durch Symbol I ist es die minimale Energiemenge. Mit anderen Worten, es ist die minimale Menge an Energie, die erforderlich ist, um einen Mol neutraler Atome in einen gasförmigen Zustand in einen Mol von Ionen mit einer positiven Belastung zu verwandeln (daher der Name).
In Form einer chemischen Gleichung ist Ionisationsenergie die für den folgende Verfahren erforderliche Energie:
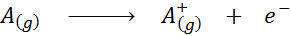
Ionisierungsenergie ist ein direktes Maß dafür, wie stark die äußersten Elektronen eines chemischen Elements verknüpft sind. Bei der Definition der Energie des Gaszustandsionisationsprozesses wird der Beitrag oder die Interferenz der intermolekularen Wechselwirkungen, die in den flüssigen und festen Zuständen auftreten, vermieden.
Auf diese Weise wird sichergestellt, dass die Ionisierungsenergie nur von den inneren Kräften des Atoms und insbesondere von der Stabilität der Elektronen abhängt, die die Valenzschicht jedes Elements bilden.
Das Entfernen eines Elektrons aus der Valencia -Schicht ist ein Prozess, der Energie erfordert. Daher handelt es sich um einen endothermen Prozess. Aus diesem Grund sind Ionisierungsenergien immer positiv (durch Konvention, wenn Energie in ein System eintritt, wird als positiv angesehen).
Es gibt mehr als eine Ionisationsenergie
Obwohl die Definition von Ionisationsenergie auf neutrale Atome angewendet wird, die zu positiven Ionen werden (dh Kationen), kann sie auch auf die aufeinanderfolgende Entfernung positiver Ionelektronen angewendet werden, dh Spezies, die bereits Elektronen bereits verloren haben.
In diesem Sinne wird die Energie, das neutrale Atom zu ionisieren.
Kann Ihnen dienen: Was sind die Elemente der Bewegung??Mit anderen Worten, die mit allen folgenden Prozessen verbundenen Energien werden als Ionisierungsenergien angesehen:
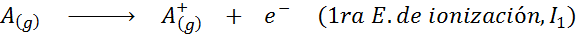
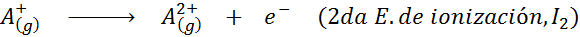
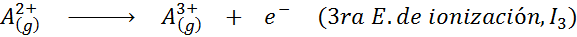
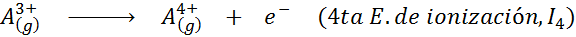
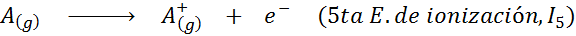
Reihenfolge der aufeinanderfolgenden Ionisierungsenergien
Für jedes Atom eines beliebigen Elements wird erfüllt, dass eine Ionisationsenergie immer größer ist als alle früheren Ionisationsenergien. Mit anderen Worten, aufeinanderfolgende Ionisierungsenergien haben die folgende Beziehung:
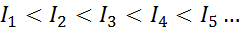
Der Grund, warum dies geschieht, ist sehr einfach. Die erste Ionisationsenergie besteht darin, ein Elektron auf ein neutrales Atom zu entfernen. Die zweite Ionisationsenergie bedeutet jedoch, ein Elektron an ein Atom zu bringen, das bereits das erste verloren hat.
Das Fehlen einer Elektron. Darüber hinaus verringert diese Abwesenheit auch den Schildeffekt, den Elektronen an den äußersten Elektronen haben, sodass der Kern sie stärker anziehen kann.
Das Ergebnis besteht der Tabelle periodisch.
Z | Element | Erste | Zweite | Dritte | Quartal | Fünfte | Sechste |
1 | H | 1312 | |||||
2 | Er | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Sei | 899 | 1757 | 14850 | 21005 | ||
5 | B | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | ENTWEDER | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
10 | Ne | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
Periodischer Trend der Ionisationsenergie
Die Ionisierungsenergie ist eine periodische Eigenschaft, die von links nach rechts und von unten zur Periodenzüchter steigt, wie in den folgenden Grafiken zu sehen ist.
Kann Ihnen dienen: Lineare Dilatation: Was ist es, Formel und Koeffizienten, Beispiel
Variation von I über einen Zeitraum
Wenn wir uns über einen Zeitraum von links nach rechts bewegen, wird etwas bezeichnet, als die effektive Kernbelast.
Dies bedeutet, dass die Kraft, mit der der Kern in der Lage ist, die Elektronen von Valencia anzuziehen.
Variation von I in einer Gruppe
Wenn wir in einer Gruppe absteigen. Aus diesem Grund nimmt die Kraft, mit der der Kern Valenzelektronen anzieht.
Wie man Ionisierungsenergie bestimmen?
Ionisationsenergie ist eine experimentell bestimmte Menge durch eine Reihe von Techniken, die zusammen die Photoelektronenspektroskopie genannt werden.
Diese Techniken basieren auf einem Phänomen, das dem photoelektrischen Effekt sehr ähnlich ist, bei dem die elektromagnetische Strahlung die Elektronen eines Atoms starten kann, und die Differenz zwischen Strahlungsenergie und kinetischer Energie, mit der Elektronen abgefeuert werden, repräsentiert die Ionisationsenergie.
Die verschiedenen Techniken der Photoelektronenspektroskopie ermöglichen die Analyse der Energien, die praktisch jedes Elektron mit seinem Kern verknüpft ist, unabhängig davon, ob ein Elektron von Valencia oder ein internes Elektron.
Beispiele für Ionisierungsenergie
Erste Ionisationsenergien von edlen Gasen
Die edlen Gase haben die stabilsten elektronischen Konfigurationen aller Elemente der Periodenzüchtertabelle. Aus diesem Grund haben sie auch die größten Ionisationsenergien. Die erste Ionisationsenergie jeder der edlen Gase wird unten dargestellt:
-
Helium
Seine erste Ionisationsenergie beträgt 2373 kJ/mol, die höchste im gesamten Periodenzüchter.
-
Neon
Seine erste Ionisationsenergie beträgt 2080 kJ/mol und der zweithöchste.
-
Argon
Seine erste Ionisationsenergie beträgt 1521 kJ/mol. Nur die F, NE und er haben größere Ionisationsenergien.
-
Kripton
Die erste Ionisationsenergie beträgt 1350 kJ/mol. Es ist nicht so hoch wie die anderen, aber es ist immer noch größer als die seiner benachbarten Elemente.
-
Xenon
Das Gleiche, was über den Kripton gesagt wird, kann das Xenon mit seiner ersten Ionisationsenergie von 1170 kJ/mol gesagt werden.
Kann Ihnen dienen: Wurmloch: Geschichte, Theorie, Typen, FormationErste und zweite Ionisationsenergien von alkalischen Metallen
Alkalische Metalle haben wiederum die geringste erste Ionisationsenergie und die größte zweite Ionisationsenergie aller Elemente:
-
Lithium
Seine erste Ionisationsenergie beträgt weniger als ein Viertel der des HE, aber das Lithium hat die größte zweite Ionisationsenergie aller Elemente, die 7300 kJ/mol sind.
-
Natrium
Das Natrium verliert sein erstes Elektron sehr leicht, da es die elektronische Konfiguration des NE erwerbt. Um das zweite Elektron zu beseitigen, müssen Sie jedoch 4560 kJ/mol liefern.
-
Kalium
Die erste Kaliumionisierungsenergie beträgt nur 418,7 kJ/mol, während der zweite 3052 kJ/mol ist, erheblich höher als die seiner Nachbarn.
-
Rubidium
Mit einer Ionisationsenergie von 403 kJ/mol ist Rubidio eines der Elemente mit weniger Ionisationsenergie. Der zweite ist jedoch 2633 kJ/mol.
-
Cäsium
Seine erste Ionisationsenergie beträgt nur 375 kJ/mol und die zweite 2234 kJ/mol, sogar niedriger als die erste Heliumionisierungsenergie.

