Innere Energie
- 723
- 77
- Luca Holdt
Wir erklären, was interne Energie ist, seine Funktion, wie man sie berechnet und mehrere Beispiele angeben
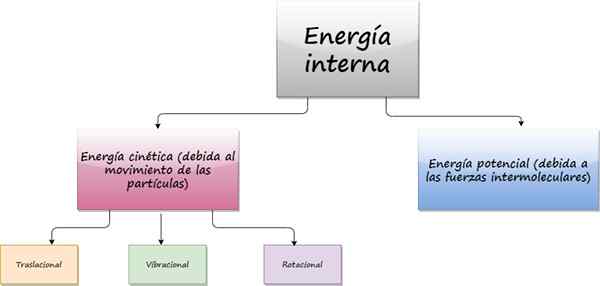
 Diagramm, das Beiträge zur internen Energie eines Systems zeigt. Quelle: f. Zapata
Diagramm, das Beiträge zur internen Energie eines Systems zeigt. Quelle: f. Zapata Was ist interne Energie?
Der innere Energie Aus einem Objekt stammt aus der zufälligen Bewegung, dass die Atome und Moleküle, die sie zusammensetzen. Auch wenn das Objekt in der mikroskopischen Ebene perfekt in Ruhe ist, bewegt sich die Partikel, die es bestehen.
Da sich diese Partikel bewegen, haben sie kinetische Energie, die Teil ihrer inneren Energie ist. Der andere Beitrag zur inneren Energie ist die potenzielle Energie, die aus intermolekularen Kräften stammt und für die Aufrechterhaltung des Zusammenhalts der Substanz verantwortlich ist.
Diese intermolekularen Kräfte sind normalerweise elektromagnetischer Ursprung, aber auch Gravitations- und Kernkräfte beteiligen sich.
Abhängig von der Art der Bewegung von Partikeln kann die kinetische Energie sein:
- Translational
- Schwingung
- Rotation
Die Temperatur misst nur die translationale kinetische Energie der Partikel. Im Prinzip ist die innere Energie bei größerer Temperatur größer, aber dies hängt auch von der Masse ab. A Beispiel Das Problem klärt: Ein Glas mit warmem Wasser hat weniger innere Energie als ein See bei Raumtemperatur, obwohl die Temperatur des Glass höher ist, und das liegt daran, dass mehr Wasser im See ist als im Glas.
In jedem Fall ist die interne Energie eines Substanz nicht spürbar, sie hängt weder von ihrer Bewegung ab, noch hängt sie von seiner relativen Position in Bezug auf andere Objekte ab. Zum Beispiel ist die innere Energie eines Glass mit Wasser bei Raumtemperatur gleich, wenn sich das Glas auf einem Tisch befindet oder wenn es sich auf dem Boden befindet.
Kann Ihnen dienen: Nicht -Koplanarvektoren: Definition, Bedingungen, ÜbungenInterne Energiefunktion
Interne Energie, die normalerweise als U bezeichnet wird, ist eine Funktion, die von den thermodynamischen Variablen des Systems abhängt, wie z. B. Temperatur T und Volumen V. Daher kann es mathematisch ausgedrückt werden als:
U = u (t, v)
In Wirklichkeit ist der absolute Wert der internen Energie eines Systems nicht relevant, was zählt, ist seine Variation, die mit dem griechischen Buchstaben δ („Delta“) bezeichnet wird:
ΔU = u Initial - ODER Finale
Jetzt kann die interne Energie variiert werden, wenn Wärme hinzugefügt oder extrahiert wird. Hinzufügen von Wärme Es ist möglich, dass das System einen bestimmten Job macht, z. B. einen Kolben im Zylinder eines Motors.
Das erste Gesetz der Thermodynamik
Aus dem ersten Gesetz der Thermodynamik wird festgestellt, dass dies festgestellt wurde Die Variation der internen Energie Von einem System entspricht:
ΔU = q - w
Wo ist die Menge an Wärme, die auf das System übertragen wird und W ist die Arbeit, die das System leistet, falls es einige ausführt. Alles wird in Joule im internationalen System der Einheiten gemessen.
Wenn das System nicht funktioniert, wird die gelieferte Wärme in seiner Gesamtheit verwendet, um die interne Energie des Systems zu erhöhen.
Das Folgende folgt aus dem vorherigen Ausdruck:
- ΔU> 0 bedeutet, dass das System seine interne Energie erhöht
- ΔU < 0 la energía interna del sistema disminuye
- Q> 0 Das System absorbiert Wärme
- W> 0 Das System funktioniert.
Wie man die interne Energie berechnet?
Das monoatomische ideale Gas
Im monoatomischen idealen Gasmodell (ein einzelnes Atom) interagieren Partikel nicht miteinander, so dass translationale kinetische Energie der einzige Beitrag zu innerer Energie oder Gas ist. Es gibt einen Theorem, genannt Ausrüstungstheorem, was besagt, dass jeder Freiheitsgrad eine Energie hat, die gleich ist:
Es kann Ihnen dienen: Wellenbeugung: Konzept und BeispieleWobei T die Temperatur und R ist die Konstante der idealen Gase, deren Wert in Einheiten des internationalen Systems lautet:
8.314472 j/mol ∙ k
Ein Freiheitsgrad stellt die Möglichkeit dar, sich in einer bestimmten Richtung im Weltraum zu bewegen. Ein ideales Gasteilchen kann sich in die drei Richtungen des Raums bewegen. Daher ist die Energie von N -Mol Gas:
Wärmemenge
Unter der Annahme, dass Wärme zu einem System hinzugefügt wird und dies nicht funktioniert, wird diese Wärme nur zur Erhöhung der inneren Energie des Systems verwendet. Die Wärmemenge, die proportional zur Masse m des Systems und der Temperaturänderung sein muss:
Q ∝ m · δt
Die Verhältnismäßigkeitskonstante hängt von der Substanz ab und heißt spezifische Wärme. Wenn Sie C zu dieser Konstante anrufen, ist die Hitze:
Q = mc · δt
Da wird die Wärme umgekehrt, um die innere Energie zu erhöhen:
Q = mc · δt = ΔU
ΔU entspricht Die Variation In innerer Energie.
Beispiele für interne Energie
1. Temperaturschwankungen
Änderungen der Temperatur der Substanzen erzeugen wiederum Veränderungen ihrer inneren Energie. Dies passiert zum Beispiel beim Kochen. Durch Erhitzen von Lebensmitteln nimmt die Aufregung seiner Moleküle zu, kinetische Energie nimmt zu und tut daher seine innere Energie.
2. Interne Energie von zwei Substanzen bei der gleichen Temperatur
Zwei Substanzen mit der gleichen Temperatur haben nicht unbedingt die gleiche interne Energie, da sie von zwei Beiträgen abhängt: kinetische Energie und potentielle Energie.
Wenn die Substanzen die gleiche Temperatur haben, kann bestätigt werden, dass die translationale kinetische Energie ihrer Partikel gleich ist, die potenzielle Energie jedoch unterschiedlich ist, da dies von der Konfiguration der konstituierenden Atome abhängt.
Kann Ihnen dienen: hydrostatischer Druck: Formel, Berechnung, Beispiele, Übungen3. Wärmeausdehnung
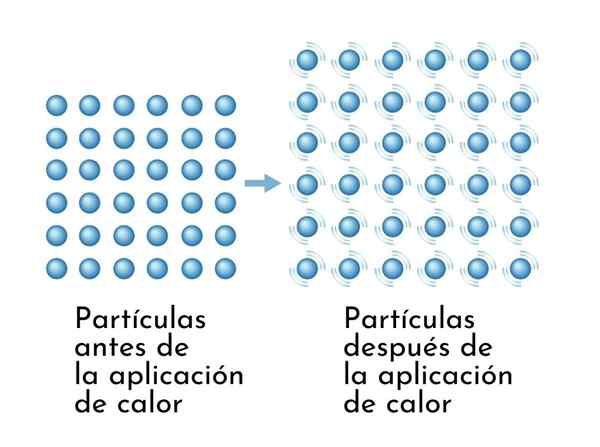 Substanzen expandieren beim Erhitzen, da die Zunahme der inneren Energie dazu führt
Substanzen expandieren beim Erhitzen, da die Zunahme der inneren Energie dazu führt Eine sichtbare Folge von Heizungssubstanzen ist die Zunahme ihrer Abmessungen, da der durchschnittliche Abstand zwischen seinen Atomen zunimmt.
Intermolekulare Kräfte können durch Quellen simuliert werden, die Atom vereinen.
4. Druckgase
Komprimierte Gase können interne Energie speichern, da ihre Dichte durch Verringern des Volumens und damit seine Wechselwirkungen mit den Wänden des Behälterbehälters zunimmt. Auf diese Weise kann ein komprimiertes Gas einen Job erledigen, z. B. einen Kolbenbewegung.
5. Batterien
In einer Batterie -chemische Reaktionen treten in der Lage, einen elektrischen Strom zu erzeugen, sobald die Schaltung schließt. Diese chemische potentielle Energie wird als Teil der inneren Energie des Systems betrachtet.
6. System, das Wärme absorbiert und funktioniert
Wenn ein System Wärme absorbiert, erhöht es seine innere Energie. Aber wenn er gleichzeitig einen Job macht, kann das erste Gesetz der Thermodynamik verwendet werden, um zu wissen, wie viel interne Energie verändert. Angenommen, ein System absorbiert 175 J Wärme und führt einen Job aus, der 62 J entspricht, ist die Änderung seiner internen Energie:
ΔU = Q - W = 175 J - 62 J = 113 J.



