Gibbs Free Energy -Einheiten, wie sie berechnet werden, gelöste Übungen

- 2798
- 562
- Frederike Birkemeyer
Der Gibbs freie Energie (Allgemein als g genannt) ist ein thermodynamisches Potential, das als Unterschied in der Enthalpie H definiert ist, mit Ausnahme des Produkts der Temperatur t durch die Entropie des Systems:
G = h - t s
Gibbs Free Energy wird in Joule (nach dem internationalen System), in Ergios (für das Liga -System der Einheiten), in Kalorien oder Elektronenvolt gemessen (Für Elektrovolben).
 Abbildung 1. Diagramm, das die Definition von Gibbs -Energie und seine Beziehung zu den anderen thermodynamischen Potentialen zeigt. Quelle: Atomkraft.Netz.
Abbildung 1. Diagramm, das die Definition von Gibbs -Energie und seine Beziehung zu den anderen thermodynamischen Potentialen zeigt. Quelle: Atomkraft.Netz. In den Prozessen, die bei konstantem Druck und Temperatur auftreten. In solchen Prozessen repräsentiert (g) die Energie, die im System verfügbar ist, das zur Arbeit werden kann.
Zum Beispiel nimmt bei exothermen chemischen Reaktionen die Enthalpie ab, während die Entropie zunimmt. In der Funktion der Gibbs werden diese beiden Faktoren entgegengewirkt, jedoch nur, wenn die Gibbs -Energie die Reaktion spontan auftritt.
Wenn also die Variation von G negativ ist, ist der Prozess spontan. Wenn die Gibbs -Funktion ihr Minimum erreicht, erreicht das System ein stabiles Gleichgewicht. Kurz gesagt, in einem Prozess, für den Druck und Temperatur konstant bleiben, können wir bestätigen:
- Wenn der Prozess spontan ist, dann ΔG < 0
- Wenn sich das System im Gleichgewicht befindet: ΔG = 0
- In einem nicht spontanen Prozess nimmt es zu: ΔG> 0.
[TOC]
Wie wird es berechnet?
Gibbs Free Energy (G) wird durch die am Anfang angegebene Definition berechnet:
G = h - t · s
Enthalpy H ist wiederum ein thermodynamisches Potential, das definiert ist als:
H = U + P V
- Schritt für Schritt
Als nächstes wird eine Schritt -by -Step -Analyse durchgeführt, um die unabhängigen Variablen zu kennen, von denen Gibbs -Energie eine Funktion ist:
1- Aus dem ersten Gesetz der Thermodynamik steht interne Energie mit den Entropie des Systems und seinem Volumen V für reversible Prozesse durch die unterschiedliche Beziehung zusammen:
Es kann Ihnen dienen: Ethidiumbromid: Struktur, Eigenschaften, Verwendungszwecke, ToxizitätDU = DQ - DW = TDS - PDV
Aus dieser Gleichung folgt, dass die interne Energie u eine Funktion der Variablen S und V ist:
U = u (s, v)
2- Ausgehend von der Definition von H und der Einnahme des Differentials wird erhalten:
dh = du + d (p v) = du + vdp + pdv
3- Ersetzen Sie den Ausdruck für DU, der in (1) erhalten wird: Sie müssen:
DH = TDS - PDV + VDP + PDV = TDS + VDP
Von hier aus wird der Schluss gezogen, dass Enthalpie H von der Entropie und dem Druck P abhängt, dh:
H = H (s, p)
4- Jetzt wird das Differential der gesamten Gibbs freien Energie berechnet, die erhalten:
Dg = dh -tds -sdt = tds + vdp -tds -sdt
Wobei DH durch den Ausdruck in (3) ersetzt wurde.
5- Durch die Vereinfachung erhalten Sie: Dg = vdp - sdt, Es ist klar, dass freie Energie G vom Druck und der Temperatur T abhängt als:
G = g (p, t)
- Maxwells thermodynamische Beziehungen
Aus der Analyse im vorherigen Abschnitt folgt, dass die interne Energie eines Systems eine Funktion von Entropie und Volumen ist:
U = u (s, v)
Dann das Unterschied von ODER Sei:
du = ∂SU |V Ds + ∂VU |S DV = TDS - PDV
Aus diesem Ausdruck in partiellen Derivaten kann die sogenannten maxwell -thermodynamischen Beziehungen abgeleitet werden. Teilleitungen gelten, wenn eine Funktion von mehr als einer Variablen abhängt und durch Anwenden des Satzes des folgenden Abschnitts leicht berechnet werden kann.
Maxwells erste Beziehung
∂VT |S = -MonSP |V
Um diese Beziehung zu erreichen, die Clairaut Theorem - Schwarz auf teilweisen Derivaten, in denen Folgendes heißt:
"Die gemischten Derivate zweiter Ordnung mit den ausgetauschten Variablen sind gleich, vorausgesetzt, die abgeleiteten Funktionen sind kontinuierlich und differenzierbar".
Maxwells zweite Beziehung
Ausgehend von dem, was in Punkt 3 des vorherigen Abschnitts demonstriert wurde:
Kann Ihnen dienen: Faktoren, die die Löslichkeit beeinflussenH = H (s, p) und dh = tds + vdp
Kann erhalten werden:
∂PT |S = ∂SV |P
Gehen Sie in ähnlicher Weise mit Gibbs -freier Energie fort G = g (p, t) und mit der freien Energie von Helmholtz F = f (t, v) Um die beiden anderen thermodynamischen Beziehungen von Maxwell zu erhalten.
 Figur 2. Josiah Gibbs (1839-1903) war ein amerikanischer Physiker, Chemiker und Mathematiker, der große Beiträge zur Thermodynamik geleistet hat. Quelle: Wikimedia Commons.
Figur 2. Josiah Gibbs (1839-1903) war ein amerikanischer Physiker, Chemiker und Mathematiker, der große Beiträge zur Thermodynamik geleistet hat. Quelle: Wikimedia Commons. Maxwells vier thermodynamische Beziehungen
1- mit interner Energie u: u: ∂VT |S = -MonSP |V
2- der von enthalpy h erhalten:: ∂PT |S = ∂SV |P
3- Bezogen auf die Energie von Helmholtz F: ∂TP |V = ∂VS |T
4- Verbindung mit der freien Energie von Gibbs G: ∂TV |P = -MonPS |T
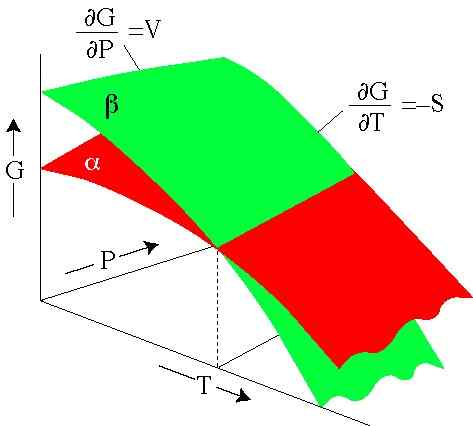 Figur 2. Gibbs 'Energie hängt von Druck und Temperatur ab. Jede Oberfläche repräsentiert eine Phase. (SERC.Carleton.Edu)
Figur 2. Gibbs 'Energie hängt von Druck und Temperatur ab. Jede Oberfläche repräsentiert eine Phase. (SERC.Carleton.Edu) Gelöste Übungen
Übung 1
Berechnen Sie die Variation der freien Energie von Gibbs für 2 Mol ideale Gas bei einer Temperatur von 300 k während einer isothermen Expansion, die zum anfänglichen Volumensystem von 20 Litern zu einem endgültigen Volumen von 40 Litern führt.
Lösung
Das Erinnern an die Definition von Gibbs freie Energie ist:
G = h - t s
Dann wird eine endliche Variation von F sein:
ΔG = ΔH - t ΔS, da Δt = 0
In idealen Gasen hängt Enthalpie nur von seiner absoluten Temperatur ab, aber da es sich um einen isothermen Prozess handelt, dann ΔH = 0 und ΔG = - t ΔS.
Für ideale Gase lautet die Entropievariation eines isothermen Prozesses:
ΔS = nr ln (v2/V1)
Das galt für den Fall dieser Übung, die wir haben:
ΔS = 2 Mol x 8,314 j/(k mol) x ln (40l/20l) = 11,53 j/k
Dann können wir die Veränderung in Helmholtz 'Energie bekommen:
ΔG = - 300k x 11,53 J/K = -3457,70 J.
Übung 2
Unter Berücksichtigung der Tatsache, dass die freie Energie von Gibbs eine Funktion von Temperatur und Druck g = g (t, p) ist; Bestimmen Sie die Variation von G während eines Prozesses, bei dem sich die Temperatur nicht ändert (isotherm) für N -Mol eines idealen monoatomischen Gas.
Kann Ihnen dienen: Strontiumhydroxid (SR (OH) ₂)Lösung
Wie oben gezeigt, hängt die Änderung der Energie von Gibbs nur von der Änderung der Temperatur t und des Volumens V ab, sodass eine infinitesimale Variation davon gemäß:
Dg = -sdt + vdp
Wenn es sich jedoch um einen Prozess handelt, bei dem die Temperatur konstant ist, dann führt df = + vdp, so dass eine endliche Variation des Drucks δP zu einer Änderung der Gibbs -Energie führt, die durch:
ΔG = + ∫ vdp = + ∫ (n r t) dp/p = + n r t ln (Δp)
Verwenden der idealen Gasgleichung:
P v = n r t
Während eines isothermen Prozesss kommt es vor:
D (p v) = p dv + v dp = 0
Das ist:
dp/p = - dv/v
Das vorherige Ergebnis kann also je nach Volumenvariation geschrieben werden ΔV:
Δg = + ∫ vdp = + ∫ (n r t) dp/p = - ∫ (n r t) dv/v = -n r t ln (ΔV)
Übung 3
In Anbetracht der folgenden chemischen Reaktion:
N20 (g) + (3/2) oder2 (g) ↔️No2 (g) bei Temperatur t = 298 K
Finden Sie die Variation der freien Energie von Gibbs und geben Sie durch das erhaltene Ergebnis an, ob es sich um einen spontanen Prozess handelt oder nicht.
Lösung
Unter den Schritten:
- Erster Schritt: Reaktionsenthalpien
ΔHR = 2*ΔH (nein2 (g)) - ΔH (n20 (g)) = 2*33,2-81,6 = -15,2KJ/Mol
- Zweiter Schritt: Die Reaktions -Entropie -Variation
ΔSR = 2*s (nein2 (g)) - s (n20 (g)) - (3/2) s (oder2 (g)) = 2*240,1 - 220,1 - 1,5*205,2 = -47,7 J/(Mol*K).
- Dritter Schritt: Variation in der Gibbs -Funktion
Dieser Wert bestimmt das Gleichgewicht zwischen abnehmender Energie und zunehmender Entropie, um zu wissen, ob die Reaktion schließlich spontan ist oder nicht.
ΔGR = ΔHR -T ΔSR = -15,2 -298*(-47,7) = -985,4 j/mol
Da es sich um eine negative Variation der Gibbs -Energie handelt, kann der Schluss gezogen werden, dass es sich um eine spontane Reaktion bei Temperatur von 298 k = 25 ° C handelt.
Verweise
- Castaños e. Freien Energieübungen. Erholt von: Lidiaconlachimica.WordPress.com.
- Cengel, und. 2012. Thermodynamik. 7. Ausgabe. McGraw Hill.
- Librettexts. Gibbs freie Energie. Erholt von: Chem.Librettexts.Org
- Librettexts. Was sind freie Energie. Erholt von: Chem.Librettexts.Org
- Wikipedia. Gibbs freie Energie. Geborgen von: ist.Wikipedia.com
- Wikipedia. Gibbs freie Energie. Abgerufen von: in.Wikipedia.com
- « MOHR -Methodenfundamentaldaten, Reaktionen, Verfahren, verwendet
- Kristallines Systemkonzept und Charakterisierung, Typen, Beispiele »

