Helmholtz Free Energy -Einheiten, wie es berechnet wird, gelöste Übungen

- 3885
- 50
- Frederike Birkemeyer
Der Helmholtz freie Energie Es ist ein thermodynamisches Potential, das die nützliche Arbeit eines geschlossenen Systems unter konstanter Temperatur und Volumenbedingungen misst. Helmholtz 'freie Energie wird als bezeichnet als F Und es ist definiert als der Unterschied von der inneren Energie ODER weniger das Temperaturprodukt T Für Entropie S:
F = u - t · s
Da es sich um Energie handelt, wird es in Joule im Internationalen System (SI) gemessen, obwohl andere geeignete Einheiten auch Ergios (CGS), Kalorien oder Elektronenvolt (EV) sein können.
 Abbildung 1. Definition von Helmholtz 'Energie. Quelle: Pixabay.
Abbildung 1. Definition von Helmholtz 'Energie. Quelle: Pixabay. Die negative Variation der Energie von Helmholtz während eines Prozesses wird mit der maximalen Arbeit gleichgesetzt, die das System in einem isocorischen Prozess durchführen kann, dh dem konstanten Volumen. Wenn das Volumen nicht konstant ist, kann ein Teil dieser Arbeit in der Umgebung erfolgen.
In diesem Fall beziehen wir uns auf Arbeiten, in denen das Volumen nicht variiert, wie z. B. elektrische Arbeit.
Wenn die Temperatur ebenfalls konstant ist, wird die Energie von Helmholtz minimiert, wenn das Gleichgewicht erreicht ist. Bei all dem ist die Energie von Helmholtz besonders nützlich bei Prozessen mit konstantem Volumen. In diesem Fall haben Sie:
- Für einen spontanen Prozess: ΔF < 0
- Wenn sich das System im Gleichgewicht befindet: ΔF = 0
- In einem nicht spontanen Prozess: Δf> 0.
[TOC]
Wie wird Helmholtz -freie Energie berechnet??
Wie zu Beginn erwähnt, wird die Energie von Helmholtz als "die interne Energie oder das System mit Ausnahme des Produkts des Systems absolute T -Temperatur durch die Entropie des Systems" definiert:
F = u - t · s
Es ist eine Funktion der Temperatur t und Volumen v. Die Schritte zur Visualisierung dies sind die folgenden:
Kann Ihnen dienen: interne Elektronen- Ab dem ersten Gesetz der Thermodynamik, interne Energie oder bezieht sich auf die Entropie des Systems und sein Volumen V für reversible Prozesse in der folgenden unterschiedlichen Beziehung:
DU = DQ - DW = TDS - PDV
Dies folgt dieser internen Energie oder ist eine Funktion von Variablen S Und V, Deshalb:
U = u (s, v)
- Jetzt die Definition von F Und es wird abgeleitet:
df = du - d (ts) = du - tds - sdt
- Ersetzen Sie dort den unterschiedlichen Ausdruck, der im ersten Schritt für DU erhalten wurde, bleibt:
Df = tds - pdv - tds - sdt = -sdt - pdv
- Schließlich wird der Schluss gezogen, dass F eine Funktion der Temperatur t und des Volumens V ist und als:
F = f (t, v)
 Figur 2. Hermann von Helmholtz (1821-1894), deutscher Physiker und Arzt, der unter anderem für seine Beiträge zu Elektromagnetismus und Thermodynamik anerkannt ist, unter anderem Wissenschaftsbereiche. Quelle: Wikimedia Commons.
Figur 2. Hermann von Helmholtz (1821-1894), deutscher Physiker und Arzt, der unter anderem für seine Beiträge zu Elektromagnetismus und Thermodynamik anerkannt ist, unter anderem Wissenschaftsbereiche. Quelle: Wikimedia Commons. Spontane Prozesse
Die Energie von Helmholtz kann als allgemeines Kriterium der Spontanität in isolierten Systemen angewendet werden, aber bevor einige Konzepte angegeben werden sollten:
- A System geschlossen Es kann Energie mit der Umwelt austauschen, kann aber keine Materie austauschen.
- Stattdessen a Isoliertes System tauschte keine Materie oder Energie mit der Umwelt aus.
- Endlich a offenes System Austausch Materie und Energie mit der Umwelt.
 Figur 3. Thermodynamische Systeme. Quelle: Wikimedia Commons. Fjgar (Bis) [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0)]].
Figur 3. Thermodynamische Systeme. Quelle: Wikimedia Commons. Fjgar (Bis) [CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. In reversiblen Prozessen wird die Variation der internen Energie wie folgt berechnet:
Du = tds - pdv
Nehmen wir nun an, ein konstantes Volumenprozess (isocoric), bei dem der zweite Term des vorherigen Ausdrucks einen Nullbeitrag hat. Es muss auch daran erinnert werden, dass nach dem Clausius -Ungleichheit:
DS ≥ DQ/T
Eine solche Ungleichheit gilt für ein isoliertes thermodynamisches System.
So dass für einen Prozess (reversibel oder nicht), bei dem das Volumen konstant gehalten wird, erfüllt wird:
Kann Ihnen dienen: Phosphorsäure (H3PO4)T ds ≥ du (Bei festem Volumen)
Berücksichtigen, dass:
df = du - t ds
Wir müssen in einem isocorischen Prozess bei konstanter Temperatur erfüllt werden: Df ≤ 0, Wie am Anfang angegeben.
So dass die Energie von Helmholtz F in einem spontanen Prozess eine abnehmende Menge ist, während es sich um ein isoliertes System handelt. F erreicht seinen minimalen und stabilen Wert, wenn reversibler Saldo erreicht wurde.
Gelöste Übungen
Übung 1
Berechnen Sie die Variation der freien Energie von Helmholtz F für 2 Mol ideale Gas bei einer Temperatur von 300 k während einer isothermen Ausdehnung, die zum System eines Anfangsvolumens von 20 Litern zu einem endgültigen Volumen von 40 Litern führt.
Lösung
Ausgehend von der Definition von F:
F = u - t s
Dann wird eine endliche Variation von F, als ΔF bezeichnet, sein:
ΔF = ΔU - t ΔS
Wie die Aussage feststellt, dass die Temperatur konstant ist: ΔT = 0. In idealen Gasen hängt die interne Energie jedoch nur von seiner absoluten Temperatur ab, aber da es sich um einen isothermen Prozess handelt, dann ΔU = 0 Und ΔF = - t ΔS. Für ideale Gase wird die Entropievariation eines isothermen Prozesses so geschrieben:
ΔS = n.R.ln (v2/V1)
Anwendung dieses Ausdrucks:
ΔS = 2 Mol x 8,314 j/(k mol) x ln (40l/20l) = 11,53 j/k
Schließlich lautet die Änderung der Energie von Helmholtz:
ΔF = - t ΔS = - 300k x 11,53 J/K = -3457,70 J.
Übung 2
In einem Zylinder gibt es einen Kolben, der ihn in zwei Abschnitte und auf jeder Seite des Kolbens unterteilt N Maulwürfe eines idealen monoatomischen Gases, wie in der folgenden Abbildung gezeigt.
Die Zylinderwände sind gute Wärmeleiter (diathermisch) und stehen mit einem T -Temperaturreservoir in Kontaktentweder.
Das anfängliche Volumen jedes der Zylinderabschnitte ist V1i und v2i, während seine endgültigen Bände v sind1f und v2f Nach einer fraglichsten Verschiebung. Der Kolben bewegt sich mit einem Kolben, der die beiden Zylinder -Tapas hermetisch überschreitet.
Es kann Ihnen dienen: Tecnecio (TC): Struktur, Eigenschaften, Verwendungen, erhaltenEs wird gebeten zu finden:
a) die Veränderung der internen Gasergie und die Arbeit des Systems und
b) Helmholtzs Energievariation.
Lösung für
Während sich der Kolben bewegt.
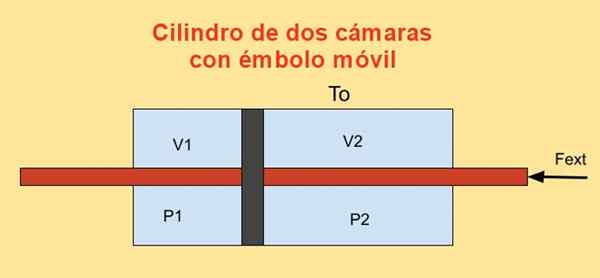 Figur 4. Variation der freien Energie F in einem Zylinder mit zwei Kameras. Quelle: f. Zapata.
Figur 4. Variation der freien Energie F in einem Zylinder mit zwei Kameras. Quelle: f. Zapata. Die Arbeit Dw Von externer Kraft gemacht Fext während einer infinitesimalen Verschiebung Dx Ist:
Dw = - fext Dx = (p)1 - P2) A dx = p1 Dv1 + P2 Dv2
Wo die Beziehung verwendet wurde Dv1 = - dv2 = A dx, Sein Zu Der Kolbenbereich. Andererseits lautet die Variation von Helmholtz 'Energie:
Df = -sdt - pdv
Da sich während des Prozesses nicht ändert, ändert sich die Temperatur nicht dt = 0 Und Df = - pdv. Anwenden Sie diesen Ausdruck auf jeden Abschnitt des Zylinders, den Sie haben:
dw = p1 Dv1 + P2 Dv2 = - df1 - Df2
Sein F1 Und F2 Helmholtz 'Energien in jedem der Kameras.
Endliche W -Arbeiten können aus der endlichen Variation der Energie von Helmholtz jeder Kamera berechnet werden:
W = -δf1 - Δf2
Lösung b
Um die Energieveränderung von Helmholtz zu finden, wird die Definition verwendet: F = u - t s. Wie in jeder Kamera haben Sie ein ideales monoatomisches Gas bei konstanter Temperatur Tentweder, Die interne Energie ändert sich nicht (ΔU = 0), so dass: Δf = - tentweder ΔS. Neben:
ΔS = nr ln (vF/Gesehen)
Das ermöglicht das Ersetzen schließlich die geleisteten Arbeiten:
W = -tentweder Nr ln (v1f /V1i) -To nr ln (v2f /V2i) = -Δf1 -Δf2
W = - zu nr ln [(v1f ⋅ v1i)/(V2f .V2i)] = - ΔFgesamt
Sein Δfgesamt Die Gesamtvariation der Energie von Helmholtz.
Verweise
- Castaños e. Freien Energieübungen. Erholt von: Lidiaconlachimica.WordPress.com
- Librettexts. Helmholtz -Energie. Erholt von: Chem.Librettexts.Org
- Librettexts. Was sind freie Energie. Erholt von: Chem.Librettexts.Org
- Wikipedia. Helmholtz -Energie. Geborgen von: ist.Wikipedia.com
- Wikipedia. Helmholtz freie Energie. Abgerufen von: in.Wikipedia.com

